10.化学反应条件(浓度、温度、加入实际量或顺序等)的变化会影响化学反应结果.下列对产生不同化学反应结果的影响因素分析错误的是( )
| 选项 | 反应物质 | 反应结果 | 影响因素 |
| A | Na O2 | Na2O Na2O2 | 反应温度 |
| B | Cu HNO3 | NO NO2 | 铜的还原性 |
| C | 澄清石灰水 CO2 | 浑浊或者澄清 | CO2通入量 |
| D | Na2CO3溶液 盐酸 | 立即产生气体或最后产生气体 | 试剂加入顺序 |
| A. | A | B. | B | C. | C | D. | D |
9.下列有关NaHSO3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Mg2+、Cl2、SO42-可以大量共存 | |
| B. | 已知电离平衡常数K(H2SO3)>K(H2CO3)>K(HSO3-),则该溶液中NH4+、HCO3-、Na+、Cl-不可以大量共存 | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O | |
| D. | 与稀HNO3反应的离子方程式:HSO3-+H+=SO2↑+H2O |
6.有一未知浓度的稀硫酸25mL,先加入25mL5mol/LBaCl2溶液后,改加NaOH溶液,结果用去1.0mol/LNaOH溶液25mL恰好完全中和.则稀硫酸的物质的量浓度为( )
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 2.0mol/L |
5.下列物质中,不能通过单质间直接化合得到的是( )
| A. | FeCl3 | B. | FeI3 | C. | Na2O2 | D. | RbCl |
4.下列保存物质的方法正确的是( )
| A. | 液氯贮存在干燥的钢瓶里 | |
| B. | 少量的锂、钠、钾均保存在煤油中 | |
| C. | 浓溴水保存在带橡皮塞的棕色细口瓶中 | |
| D. | 用排水法收集满一瓶氢气,用玻璃片盖住瓶口,瓶口朝上放置 |
1.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备Ni SO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).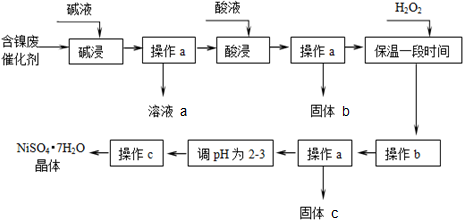
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a的名称是过滤.
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝,聚合氯化铝是一种新型净水剂,其中铝主要以[AlO2Al12(OH)24•(H2O)12]2+(用Alx表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Aln含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24•(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
0 167145 167153 167159 167163 167169 167171 167175 167181 167183 167189 167195 167199 167201 167205 167211 167213 167219 167223 167225 167229 167231 167235 167237 167239 167240 167241 167243 167244 167245 167247 167249 167253 167255 167259 167261 167265 167271 167273 167279 167283 167285 167289 167295 167301 167303 167309 167313 167315 167321 167325 167331 167339 203614

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝,聚合氯化铝是一种新型净水剂,其中铝主要以[AlO2Al12(OH)24•(H2O)12]2+(用Alx表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Aln含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24•(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
 (1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图: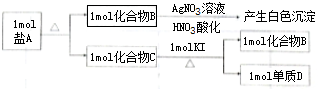
 ;
;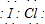 ;化合物C中显正价的是碘元素;
;化合物C中显正价的是碘元素;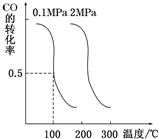 随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.