题目内容
3.某盐A由三种元素组成,其相关的转化关系如图(所有产物均已标在框图上),其中C为红棕色液体,其化学性质与其组成元素的单质相似.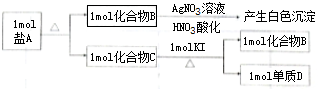
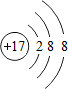
(1)A的化学式为KICl2,画出B中阴离子的原子结构示意图
 ;
;(2)写出C的电子式
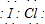 ;化合物C中显正价的是碘元素;
;化合物C中显正价的是碘元素;(3)写出化合物C与KI反应的化学方程式KI+ICl=I2+KCl;
(4)判断下列物质能与C发生反应的有ABC.
A.SO2 B.H2O C.乙烯 D.Na2SO4.
分析 分析转化关系1molC+KI=1mol化合物B+1mol单质D,1mol化合物B加入硝酸酸化的硝酸银溶液反应生成白色沉淀,说明B中含有Cl元素,推断C中含有Cl元素,所以生成单质D推断为I2,B为KCl,则依据氧化还原反应实质判断C为ICl,为红棕色液体,其化学性质与其组成元素的单质相似,1mol盐A中含有Cl、I、K,依据元素化合价代数和为0片,A为KICl2,依据推断分析回答问题;
(1)A推断为KICl2,B为氯化钾,阴离子为Cl-;
(2)C为ICl,碘化合价为+1价,氯元素化合价为-1价,形成的是共价化合物;
(3)C和KI反应发生的是碘元素的归中反应,生成碘单质;
(4)C为ICl为红棕色液体,其化学性质与其组成元素的单质相似,具有强氧化性,能氧化还原性物质和不饱和碳原子形成的双键发生加成反应,和水发生自身氧化还原反应;
解答 解:分析转化关系,1molC+KI=1mol化合物B+1mol单质D,1mol化合物B加入硝酸酸化的硝酸银溶液反应生成白色沉淀,说明B中含有Cl元素,推断C中含有Cl元素,所以生成单质D推断为I2,B为KCl,则依据氧化还原反应实质判断C为ICl,为红棕色液体,其化学性质与其组成元素的单质相似,1mol盐A中含有Cl、I、K,依据元素化合价代数和为0判断,A为KICl2,依据推断分析回答问题;
(1)A推断为KICl2,B为氯化钾,阴离子为Cl-,根据氯为非金属元素,最外层电子数多于4,易得到电子,形成阴离子,氯元素是17号元素,故氯离子的核内质子数为17,当核电荷数=质子数<核外电子数,为阴离子,故氯离子的结构示意图是: ;
;
故答案为:KICl2,
(2)氯化碘结构和氯气相似,Cl原子和I原子之间共用一对电子,C为ICl,碘化合价为+1价,氯元素化合价为-1价,形成的是共价化合物,所以氯化碘的电子式为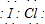 ,氯化碘中氯原子非金属性大于碘,所以碘显+1价;
,氯化碘中氯原子非金属性大于碘,所以碘显+1价;
故答案为: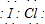 ,碘;
,碘;
(3)C和KI反应发生的是碘元素的归中反应,生成碘单质,反应的化学方程式为:KI+ICl=I2+KCl;
故答案为:KI+ICl=I2+KCl;
(4)C为ICl为红棕色液体,其化学性质与其组成元素的单质相似,具有强氧化性,能氧化还原性物质和不饱和碳原子形成的双键发生加成反应,和水发生自身氧化还原反应;
A.SO2 B具有还原性可以被ICl氧化,故A符合;
B、根据氯气和水反应方程式知,氯化碘和水反应方程式为ICl+H2O═HCl+HIO,H2O和ICl反应,故B符合; C.乙烯含有不饱和碳碳双键,类比氯气和碳碳双键发生加成反应,故C符合;
D.Na2SO4溶液和ICl不能发生反应,故D不符合;
故选ABC;
故答案为:ABC.
点评 本题考查了氧化还原反应,根据反应中是否有电子转移判断是否是氧化还原反应,知道氯化碘中元素化合价是解本题关键,根据氯气的性质采用知识迁移的方法分析氯化碘的性质,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 原子是一个简单的不可分割的实心球体 | |
| B. | 原子核内质子数不等于核外电子数,所以原子显电性 | |
| C. | 不同种类的原子,核内质子数不同,核外电子数也不同 | |
| D. | 不同种类的原子,核内质子数不同,核外电子数可能相同 |
| A. | 烷烃与烯烃不可能是同分异构体 | |
| B. | 同分异构体只能存在于有机化合物之间 | |
| C. | 乙酸和甲酸甲酯不互为同分异构体 | |
| D. | 乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 |
 焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:
焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究: