10.如果ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中NA为阿伏加德罗常数的值)( )
| A. | $\frac{22.4ab}{cNA}$ L | B. | $\frac{22.4b}{acNA}$ L | C. | $\frac{22.4ac}{bNA}$ L | D. | $\frac{22.4bc}{aNA}$ L |
9. 取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.
取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.
试回答下列问题:
(1)加入盐酸后产生气体的在标准状况下的体积为0.448 L.
(2)盐酸中HCl的物质的量浓度0.2mol/L.
(3)将密闭容器中排出气体的化学式及对应的物质的量填入下表(有多少种填多少种)
(4)反应后的固体的成分(填化学式)NaOH,Na2CO3.
 取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.
取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题:
(1)加入盐酸后产生气体的在标准状况下的体积为0.448 L.
(2)盐酸中HCl的物质的量浓度0.2mol/L.
(3)将密闭容器中排出气体的化学式及对应的物质的量填入下表(有多少种填多少种)
| 化学式 | H2O | O2 | |
| 物质的量(mol) | 0.005 | 0.00175 |
8.晶体硅是一种重要的半导体材料,工业上晶体硅的制备流程如下:
石英$→_{高温}^{①}$粗硅$→_{450-500℃}^{②Cl_{2}}$$\stackrel{③精馏}{→}$高纯SiCl4$→_{高温}^{④H_{2}}$高纯硅
在高温条件下,粗硅中的杂质硼、铝、铁、磷等均能与氯气直接反应生成相应的氯化物.
有关物质物理性质:
请回答下列问题:
(1)写出工业上获得粗硅的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)通过精馏(类似多次蒸馏)可得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的元素是Al、P(填写元素符号).
(3)用SiCl4与过量干燥的H2反应制备纯硅,为保证制备纯硅实验的成功,除控制好反应温度外,还需确保实验装置中不能混入空气,原因是氢气与氧气爆炸,硅和氧气高温反应.
石英$→_{高温}^{①}$粗硅$→_{450-500℃}^{②Cl_{2}}$$\stackrel{③精馏}{→}$高纯SiCl4$→_{高温}^{④H_{2}}$高纯硅
在高温条件下,粗硅中的杂质硼、铝、铁、磷等均能与氯气直接反应生成相应的氯化物.
有关物质物理性质:
| 物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(1)写出工业上获得粗硅的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)通过精馏(类似多次蒸馏)可得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的元素是Al、P(填写元素符号).
(3)用SiCl4与过量干燥的H2反应制备纯硅,为保证制备纯硅实验的成功,除控制好反应温度外,还需确保实验装置中不能混入空气,原因是氢气与氧气爆炸,硅和氧气高温反应.
7.在NaIO3的碱性溶液中通入氯气,可以得到Na2H3IO6.下列说法错误的是( )
| A. | 在该反应中NaIO3作还原剂 | |
| B. | 碱性条件下,Na2H3IO6氧化性强于氯气 | |
| C. | 反应中生成1mol Na2H3IO6,转移2mol电子 | |
| D. | 反应中氧化产物与还原产物的物质的量之比为1:2 |
6.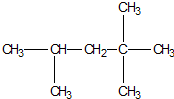 作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )
作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )
 作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )
作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )| A. | C2H4 | B. | C8H18 | C. | C7H16 | D. | C6H12 |
5.既可用于给液体加热,又可用于给固体加热的玻璃仪器是( )
| A. | 试管 | B. | 烧瓶 | C. | 烧杯 | D. | 蒸发皿 |
4.下列仪器中,能够在酒精灯火焰上直接加热的玻璃仪器是( )
| A. | 量筒 | B. | 燃烧匙 | C. | 试管 | D. | 烧杯 |
3.用量筒量取液体时,某同学操作如下:量筒放平稳,面对刻度,俯视液体凹液面最低处读数为20mL,倾倒出一部分液体,又仰视液体凹液面最低处读数为10ml.这位学生取出液体的实际体积为( )
| A. | 小于10mL | B. | 10mL | C. | 大于10mL | D. | 无法判断 |
2.与17gNH3所含的原子数相等的CO是( )
| A. | 1molCO | B. | 56gCO | C. | 1.204×1023个CO | D. | 3molCO |
1.科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
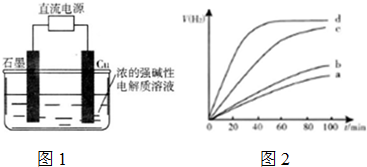
I.四种制取Cu2O的方法:
a.用炭粉在高温条件下还原CuO制备Cu2O;
b.用葡萄糖还原新制的Cu(OH)2制备Cu2O;
c.电解法制备Cu2O,装置如图1;
d.湿化学法:加热条件下用液态肼(N2H4)还原新制Cu(OH)2
可制备纳米级Cu2O,同时放出N2.
(1)方法c通过阳极氧化制得Cu2O,写出阳极的电极反应式2Cu+2OH--2e-=Cu2O+H2O.
(2)方法d的化学方程式为N2H4+4Cu(OH)2=2Cu2O+N2↑+6H2O,检验纳米Cu2O(粒子大小约几十纳米)已经生成的实验方法是丁达尔效应.
(3)方法d得到的产品中常含有Cu2O称取某产品3.52g(仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体448mL,则产品中Cu2O的质量分数为81.8%.
Ⅱ.用制得的Cu2O进行催化分解水的实验
(4)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H═+484KJ•mol-1
不同时段产生O2的物质的量见下表:
前20min的反应平均速率v(H2O)=5.0×10-5 mol.L-1.min -1,达平衡时,至少需要吸收的光能为0.968kJ.
(5)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图2.
下列叙述正确的是ACD(填字母代号).
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度.
0 167123 167131 167137 167141 167147 167149 167153 167159 167161 167167 167173 167177 167179 167183 167189 167191 167197 167201 167203 167207 167209 167213 167215 167217 167218 167219 167221 167222 167223 167225 167227 167231 167233 167237 167239 167243 167249 167251 167257 167261 167263 167267 167273 167279 167281 167287 167291 167293 167299 167303 167309 167317 203614

I.四种制取Cu2O的方法:
a.用炭粉在高温条件下还原CuO制备Cu2O;
b.用葡萄糖还原新制的Cu(OH)2制备Cu2O;
c.电解法制备Cu2O,装置如图1;
d.湿化学法:加热条件下用液态肼(N2H4)还原新制Cu(OH)2
可制备纳米级Cu2O,同时放出N2.
(1)方法c通过阳极氧化制得Cu2O,写出阳极的电极反应式2Cu+2OH--2e-=Cu2O+H2O.
(2)方法d的化学方程式为N2H4+4Cu(OH)2=2Cu2O+N2↑+6H2O,检验纳米Cu2O(粒子大小约几十纳米)已经生成的实验方法是丁达尔效应.
(3)方法d得到的产品中常含有Cu2O称取某产品3.52g(仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体448mL,则产品中Cu2O的质量分数为81.8%.
Ⅱ.用制得的Cu2O进行催化分解水的实验
(4)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H═+484KJ•mol-1
不同时段产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| N(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(5)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图2.
下列叙述正确的是ACD(填字母代号).
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度.