4.下列说法正确的是( )
①一块冰中氢、氧原子间只以化学键相结合
②金属和非金属化合形成离子键
③离子键是阳离子、阴离子的相互吸引
④双原子单质分子中的共价键一定是非极性键
⑤非金属原子间不可能形成离子键
⑥离子化合物中可能有共价键
⑦共价化合物中可能有离子键
⑧两种不同非金属元素形成的共价化合物中只有极性键.
①一块冰中氢、氧原子间只以化学键相结合
②金属和非金属化合形成离子键
③离子键是阳离子、阴离子的相互吸引
④双原子单质分子中的共价键一定是非极性键
⑤非金属原子间不可能形成离子键
⑥离子化合物中可能有共价键
⑦共价化合物中可能有离子键
⑧两种不同非金属元素形成的共价化合物中只有极性键.
| A. | ④⑥ | B. | ②④⑤ | C. | ①②③ | D. | ④⑥⑧ |
3.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
2.下列关于元素周期表和元素周期律的说法错误的是( )
| A. | 因为K比Na容易失去电子,所以K比Na的还原性强 | |
| B. | 第二周期元素从Li到F,非金属性逐渐增强 | |
| C. | 在金属和非金属的分界线处,可以找到用于作催化剂的元素 | |
| D. | O与S为同主族元素,且O比S的非金属性强 |
1.金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( )
| A. | 金刚石比石墨稳定 | |
| B. | 石墨比金刚石稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol金刚石生成1mol石墨要吸收热量 |
20.下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->C1->Br-
④稳定性:HCl>H2S>PH3
⑤熔沸点:HI>HBr>HCl>HF.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->C1->Br-
④稳定性:HCl>H2S>PH3
⑤熔沸点:HI>HBr>HCl>HF.
| A. | ①②④ | B. | ①②③ | C. | ②③④ | D. | ①②④⑤ |
19.随着碱金属、卤素原子半径的增大,下列递变规律正确的是( )
| A. | 碱金属和卤素单质的熔沸点都逐渐降低 | |
| B. | 碱金属和卤素单质的密度都依次变大 | |
| C. | 卤素的气态氢化物稳定性逐渐增强 | |
| D. | 碱金属单质还原性逐渐增强 |
18.下列分子中,所有原子都满足最外层为 8 电子结构的是( )
| A. | BF3 | B. | NF3 | C. | NH3 | D. | PCl5 |
17.下列化合物中阳离子和阴离子电子层结构相同的是( )
0 167108 167116 167122 167126 167132 167134 167138 167144 167146 167152 167158 167162 167164 167168 167174 167176 167182 167186 167188 167192 167194 167198 167200 167202 167203 167204 167206 167207 167208 167210 167212 167216 167218 167222 167224 167228 167234 167236 167242 167246 167248 167252 167258 167264 167266 167272 167276 167278 167284 167288 167294 167302 203614
| A. | NaCl | B. | MgF2 | C. | CaF2 | D. | K2O |
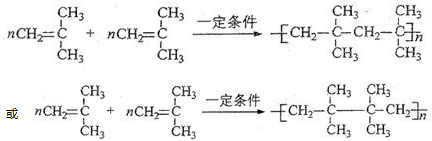
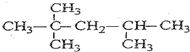 .
.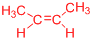 、
、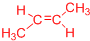 .
.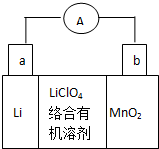 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,