11. 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
注:经检验黑色固体为Ag
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
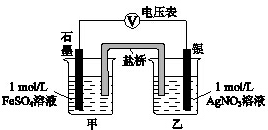
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
10.硫及其化合物有广泛应用.
(1)硫元素在周期表中的位置是第三周期ⅥA族.
(2)硒(34Se)与硫在元素周期表中位于同一主族.下列说法正确的是cd.
a.沸点:H2Se>H2S>H2O
b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大
d.SeO2和SO2含有的化学键类型相同
(3)SO2可用于制H2SO4.已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
H2O(g)=H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.
(4)为研究H2SO4生产中SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO2 7%、O2 11%、N2 82%)使之发生反应,在101kPa下达到平衡,得到如下数据:
根据上述数据,达平衡态时N2的体积分数随着温度升高而减小(填“增大”、“减小”或“不变”);575℃达平衡时,SO3的体积分数为5.8%(保留一位小数).
(5)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性.
①吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-.
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色.
(1)硫元素在周期表中的位置是第三周期ⅥA族.
(2)硒(34Se)与硫在元素周期表中位于同一主族.下列说法正确的是cd.
a.沸点:H2Se>H2S>H2O
b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大
d.SeO2和SO2含有的化学键类型相同
(3)SO2可用于制H2SO4.已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
H2O(g)=H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.
(4)为研究H2SO4生产中SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO2 7%、O2 11%、N2 82%)使之发生反应,在101kPa下达到平衡,得到如下数据:
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
(5)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性.
①吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-.
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色.
8.下列说法正确的是( )
| A. | 葡萄糖能水解成乙醇和二氧化碳 | |
| B. | 氨基乙酸、甲醛、乙二醇均可发生聚合反应 | |
| C. | 苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强 | |
| D. | 实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯 |
7.用下列装置完成相关实验,不合理的是( )
| A. |  用a制备并收集氨气 | B. |  用b制备并检验乙炔 | ||
| C. |  用c蒸馏海水得到淡水 | D. | 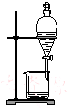 用d分离Na2CO3溶液与CH3COOC2H5 |
6.下列说法正确的是( )
| A. | 鸡蛋清溶液中加入醋酸铅溶液,会发生盐析 | |
| B. | 青苹果中富含苹果酸,因此苹果是酸性食物 | |
| C. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 | |
| D. | 氢氧化钠、碳酸钙、氢氧化铝等可作为抗酸药 |
3.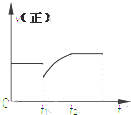 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )| A. | 增大NH3浓度的同时减小N2浓度 | B. | 增大N2和H2的浓度 | ||
| C. | 扩大容器的体积 | D. | 降低反应温度 |
2.下列图示与对应的叙述相符的( )
0 167031 167039 167045 167049 167055 167057 167061 167067 167069 167075 167081 167085 167087 167091 167097 167099 167105 167109 167111 167115 167117 167121 167123 167125 167126 167127 167129 167130 167131 167133 167135 167139 167141 167145 167147 167151 167157 167159 167165 167169 167171 167175 167181 167187 167189 167195 167199 167201 167207 167211 167217 167225 203614
| A. | 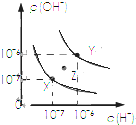 表示不同条件下水的电离平衡曲线,图中各点温度:X>Z>Y | |
| B. | 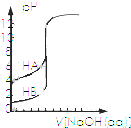 表示浓度相同的两种一元酸分别用0.1 mol/L NaOH溶液滴定曲线,酸性:HA>HB | |
| C. | 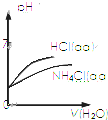 表示pH相同的NH4Cl溶液和HCl溶液分别加同体积水稀释二者pH的变化曲线 | |
| D. | 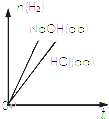 表示向等体积、等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝粉,产生H2的物质的量随时间的变化曲线 |
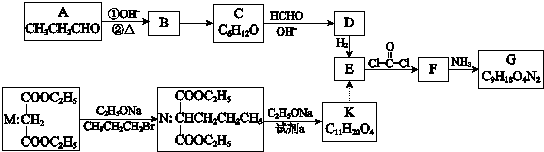
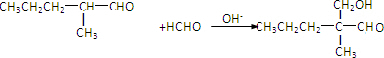 .
. .
.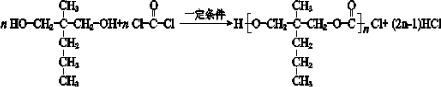 .
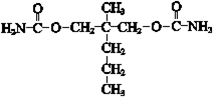
. ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是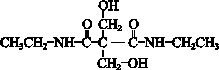 .
.



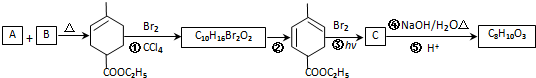
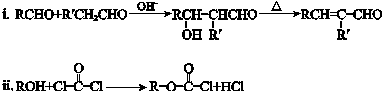
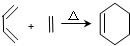 ,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2
,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2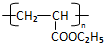 .
.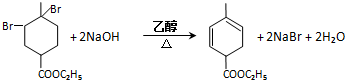 .
.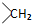 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为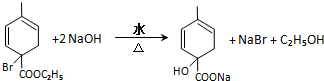 .
.