11.化学与生活密切相关,下列说法不正确的是( )
| A. | 饮用牛奶和豆浆可以缓解重金属引起的中毒 | |
| B. | 向煤中加入适量石灰石,可减少其燃烧产物中的SO2,降低对大气的污染 | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 混凝法、中和法和沉淀法是污水处理中常用的化学方法 |
7.下列有关实验的叙述,正确的是( )
| A. | 燃着的酒精灯不慎碰到失火,应立即用湿布盖灭 | |
| B. | 酸碱中和滴定实验中,滴定管和锥形瓶都要用待装溶液润洗 | |
| C. | 用浓氨水洗涤做过银镜反应的试管 | |
| D. | 测某溶液的pH时,将pH试纸浸入待测溶液中,过一会儿取出,与标准比色卡进行对比 |
6.化学与生活密切相关,下列说法不正确的是( )
| A. | Fe2O3常用作红色油漆和涂料 | B. | 氟氯烃是安全、环保的制冷剂 | ||
| C. | 聚丙烯酸钠可做“尿不湿”原料 | D. | 硅胶可用作瓶装药品干燥剂 |
5.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.

设计方案如图1,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(1)查阅资料:
①氮气不与炭粉、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热制得氮气.写出该反应的离子方程式:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O.
②使上述制得的气体通过B装置方能获得干燥的N2
(2)实验步骤:
①按图2连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.步骤②、④中都分别通入N2,其作用分别为步骤②通入氮气的目的是排除装置中的O2;步骤④通入氮气的目的是将生成的CO2全部通入澄清的石灰水中.
(3)数据处理:
①试根据实验数据分析,该反应的气体产物是CO2和CO,理由是过量炭粉与二氧化碳气体反应生成CO气体
②写出该实验中氧化铁与炭粉发生反应的化学方程式:2C+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+CO↑+CO2↑.
(4)实验优化:学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是将澄清的石灰水换成Ba(OH)2溶解度大,浓度大,使CO2被吸收更完全;碳酸钡的相对原子质量大于碳酸钙的,称量时相对误差小.
②pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.现向0.2mol/LBa(OH)2溶液中通入CO2气体,沉淀开始产生时,溶液中CO32-的PC值为7.6(已知:lg2=0.2;Ksp(BaCO3)=5.0x10-9)
③从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:在尾气出口处加一点燃的酒精灯.

设计方案如图1,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
①氮气不与炭粉、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热制得氮气.写出该反应的离子方程式:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O.
②使上述制得的气体通过B装置方能获得干燥的N2
(2)实验步骤:
①按图2连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.步骤②、④中都分别通入N2,其作用分别为步骤②通入氮气的目的是排除装置中的O2;步骤④通入氮气的目的是将生成的CO2全部通入澄清的石灰水中.
(3)数据处理:
①试根据实验数据分析,该反应的气体产物是CO2和CO,理由是过量炭粉与二氧化碳气体反应生成CO气体
②写出该实验中氧化铁与炭粉发生反应的化学方程式:2C+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+CO↑+CO2↑.
(4)实验优化:学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是将澄清的石灰水换成Ba(OH)2溶解度大,浓度大,使CO2被吸收更完全;碳酸钡的相对原子质量大于碳酸钙的,称量时相对误差小.
②pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.现向0.2mol/LBa(OH)2溶液中通入CO2气体,沉淀开始产生时,溶液中CO32-的PC值为7.6(已知:lg2=0.2;Ksp(BaCO3)=5.0x10-9)
③从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:在尾气出口处加一点燃的酒精灯.
2.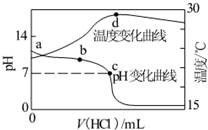 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
0 167029 167037 167043 167047 167053 167055 167059 167065 167067 167073 167079 167083 167085 167089 167095 167097 167103 167107 167109 167113 167115 167119 167121 167123 167124 167125 167127 167128 167129 167131 167133 167137 167139 167143 167145 167149 167155 167157 167163 167167 167169 167173 167179 167185 167187 167193 167197 167199 167205 167209 167215 167223 203614
 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | 氨水的电离程度a>b>c | |
| B. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) | |
| C. | c点时消耗盐酸体积V(HCl)<20.00mL | |
| D. | d点时溶液温度达到最高,之后温度略有下降,原因是NH3•H2O电离吸热 |
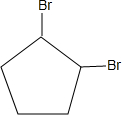 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$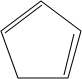 +2NaBr+2H2O;
+2NaBr+2H2O;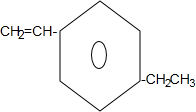 .
. (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$ (g)+3H2(g)△H
(g)+3H2(g)△H
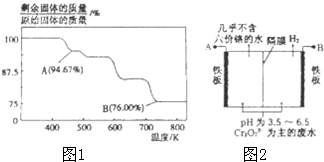 CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.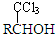 (-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾
(-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾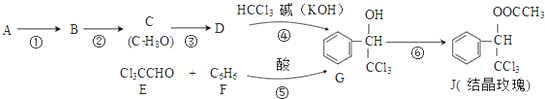
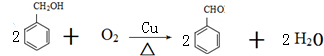 .
.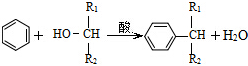 ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.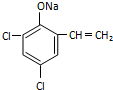 或
或 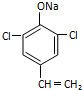 (只写一种).
(只写一种).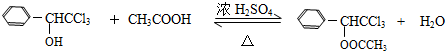 .
.