10.某溶液中可能含有Na+、K+、AlO2-、CO32-、SO32-、Cl-中的若干种离子.某同学设并完成了如下实验:
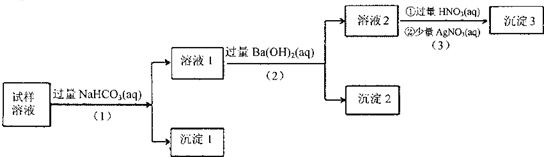
已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )

已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 沉淀2放置在空气中,若质量增加,试样中肯定存在SO32- | |
| B. | 试样溶液中加人稍过量的NH4C1溶液能得到与沉淀1成分相同的物质 | |
| C. | 上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象 | |
| D. | 试样溶液中肯定存在A102-、Cl-,其中Na+、K+至少存在1种 |
9.已知:在25℃时,向10mL 0.01mol•L-1NaCN溶液中逐滴加入0.01mol•L-1的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数(α)随pH变化的关系如图2所示,下列表述正确的是( )
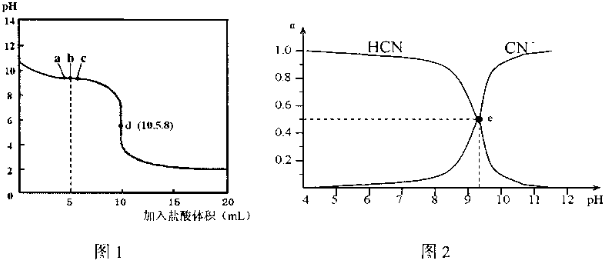

| A. | b点时,溶液中微粒浓度大小的关系:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) | |
| B. | d点溶液存在的关系:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-) | |
| C. | 图2中的e点对应图1中的c点 | |
| D. | 在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小 |
8. 化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.
化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.
已知:①Cu2++HCHO+30H-=Cu+HCOO-+2H20;
②还原性:HCHO>M(一种金属)>Cu.
下列说法正确的是( )
 化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.
化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.已知:①Cu2++HCHO+30H-=Cu+HCOO-+2H20;
②还原性:HCHO>M(一种金属)>Cu.
下列说法正确的是( )
| A. | 反应之前,应将含OH-的HCHO溶液加人到装置的左侧 | |
| B. | 右侧发生的电极反应式:HCH0-2e-+H20=HC0O-+3H+ | |
| C. | 若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移 | |
| D. | 放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现 |
7.下列说法正确的是( )
| A. | 按系统命名法,化合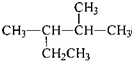 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛,完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: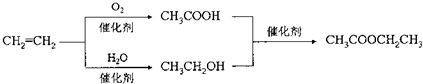 |
6.下列说法不正确的是( )
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 从加碘盐中获取碘单质的操作步骤为:溶解-萃取-分液-蒸馏 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
5.下列说法不正确的是( )
| A. | 合成氨反应在低温下能够自发进行,是因为反应物键能之和大于生成物键能之和 | |
| B. | 元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属元素 | |
| C. | 人们利用元素周期律在过渡元素中寻找各种性能优良的催化剂,以降低化学反应的活化能,从而起到很好的节能效果 | |
| D. | 超高分辨率荧光显微镜能够观察到纳米尺度的物质,用它可以获得蛋白质溶液中的分子图象 |
2.相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-l.实验测得起始、平衡时的有关数据如下表:下列叙述正确的是( )
0 167019 167027 167033 167037 167043 167045 167049 167055 167057 167063 167069 167073 167075 167079 167085 167087 167093 167097 167099 167103 167105 167109 167111 167113 167114 167115 167117 167118 167119 167121 167123 167127 167129 167133 167135 167139 167145 167147 167153 167157 167159 167163 167169 167175 167177 167183 167187 167189 167195 167199 167205 167213 203614
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 三个容器中反应的平衡常数均为K=2 | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$ mol/(L•min) |
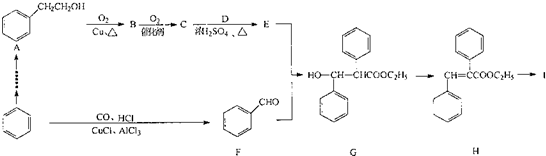
 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O:E+F--G的反应类型为加成反应.
+2H2O:E+F--G的反应类型为加成反应. +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.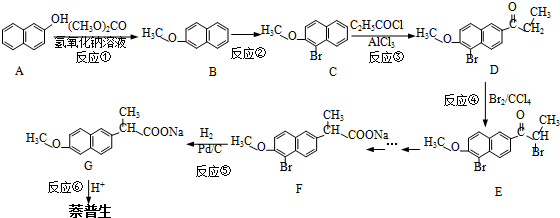
 )的化学性质与苯相似.
)的化学性质与苯相似. )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是 .
.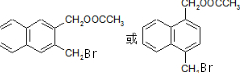 (任写一种).
(任写一种). 的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)