16.软锰矿的主要成分是二氧化锰,用软锰矿浆吸收工业废气中的二氧化硫,可以制备高纯度的硫酸锰晶体,其流程如下所示:

已知:浸出液中的金属阳离子主要是Mn2+,还含有少量的Fe2+、Al3+等,且pH<2.几种离子开始沉淀和完全沉淀时的pH如上表所示:
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是不能,pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(4)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(5)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶,过滤.利用滤渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.
0 166927 166935 166941 166945 166951 166953 166957 166963 166965 166971 166977 166981 166983 166987 166993 166995 167001 167005 167007 167011 167013 167017 167019 167021 167022 167023 167025 167026 167027 167029 167031 167035 167037 167041 167043 167047 167053 167055 167061 167065 167067 167071 167077 167083 167085 167091 167095 167097 167103 167107 167113 167121 203614

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是不能,pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(4)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(5)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶,过滤.利用滤渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.
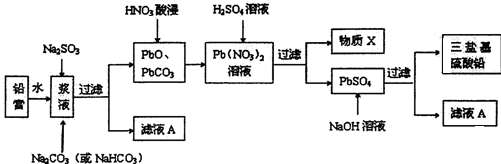

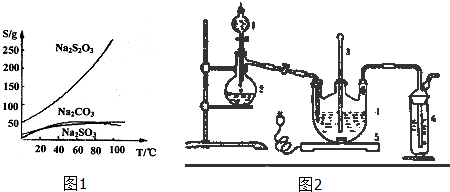


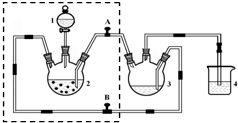 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:


 某研究小组探究:
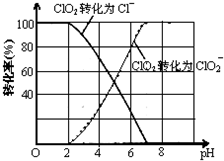
某研究小组探究: 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图: