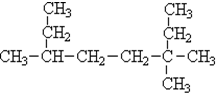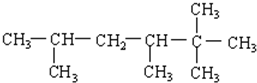8.下列说法中正确的是( )
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 由不同原子所形成的纯净物一定是化合物 | |
| C. | 含有金属元素的离子不一定是阳离子 | |
| D. | 离子化合物一定能导电 |
7.下列分子式只表示一种物质的是( )
| A. | C2H6O | B. | C3H6O | C. | C2H3Br | D. | C2H4 Br2 |
6.下表是周期表中的一部分,根据A-N在周期表中的位置,按要求回答下列问题:
(1)表中元素,氧化性最强的单质是F2,还原性最强的单质是Na(用相关的元素符号或分子式表示)
(2)最高价氧化物的水化物酸性最强的是高氯酸,呈两性的是氢氧化铝.(本小题均填物质的名称)
(3)在B、C、D、F、G、H中,原子半径从大到小的顺序为的是Na>Mg>Al>C>N>F.(用元素符号表示).
(4)在D、F、M的离子半径从大到小的顺序为的是Cl->F->Na+.(用离子符号表示).
(5)F的最高价氧化物对应的水化物和H的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
(2)最高价氧化物的水化物酸性最强的是高氯酸,呈两性的是氢氧化铝.(本小题均填物质的名称)
(3)在B、C、D、F、G、H中,原子半径从大到小的顺序为的是Na>Mg>Al>C>N>F.(用元素符号表示).
(4)在D、F、M的离子半径从大到小的顺序为的是Cl->F->Na+.(用离子符号表示).
(5)F的最高价氧化物对应的水化物和H的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
5.可以验证硫元素的非金属性比氯元素弱的事实是( )
①S在常温下是固体单质,Cl2在常温下是气体
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铁反应,其产物是FeS、FeCl3
④高氯酸(HClO4)的酸性比硫酸强
⑤气态氢化物的稳定性:H2S<HCl.
①S在常温下是固体单质,Cl2在常温下是气体
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铁反应,其产物是FeS、FeCl3
④高氯酸(HClO4)的酸性比硫酸强
⑤气态氢化物的稳定性:H2S<HCl.
| A. | ①②④ | B. | ②④ | C. | ②③④⑤ | D. | ①③⑤ |
4.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是( )
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol $\stackrel{+5}{I}$被氧化 |
3.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为:Zn+2 OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-,总反应式为Ag2O+Zn=ZnO+2Ag,根据上述反应式,判断下列叙述中正确的是( )
0 166907 166915 166921 166925 166931 166933 166937 166943 166945 166951 166957 166961 166963 166967 166973 166975 166981 166985 166987 166991 166993 166997 166999 167001 167002 167003 167005 167006 167007 167009 167011 167015 167017 167021 167023 167027 167033 167035 167041 167045 167047 167051 167057 167063 167065 167071 167075 167077 167083 167087 167093 167101 203614
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 在使用过程中,电子由Ag2O经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn极发生还原反应,Ag2O极发生氧化反应 |
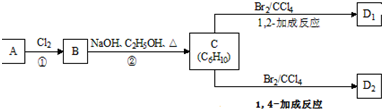
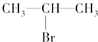 (主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.
(主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.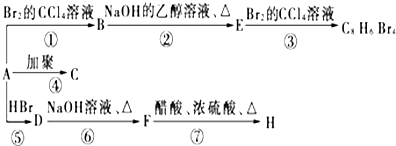

 ,D
,D ,E
,E ,F
,F .
.
 .
.