题目内容
5.可以验证硫元素的非金属性比氯元素弱的事实是( )①S在常温下是固体单质,Cl2在常温下是气体
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铁反应,其产物是FeS、FeCl3
④高氯酸(HClO4)的酸性比硫酸强
⑤气态氢化物的稳定性:H2S<HCl.
| A. | ①②④ | B. | ②④ | C. | ②③④⑤ | D. | ①③⑤ |
分析 元素的非金属性越强,其最高价氧化物的水化物酸性越强、其氢化物的稳定性越强、与氢气化合越容易,其单质的氧化性越强,还可以根据非金属之间的置换反应判断非金属性强弱,据此分析解答.
解答 解:①非金属性强弱与物质的状态无关,所以不能根据S在常温下是固体单质、Cl2在常温下是气体判断非金属性强弱,故错误;
②元素的非金属性越强,其单质的氧化性越强,向氢硫酸溶液中滴入氯水有单质硫生成,该反应中Cl元素化合价由0价变为-1价、S元素化合价由-2价变为0价,所以氯气是氧化剂、S是氧化产物,氧化性氯气大于S,则非金属性Cl>S,故正确;
③元素的非金属性越强,其单质的氧化性越强,硫、氯气分别与铁反应,其产物是FeS、FeCl3,氯气能将铁氧化为较高价、S元素只能将Fe氧化为较低价,则氧化性氯气大于S,非金属性Cl>S,故正确;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强,高氯酸(HClO4)的酸性比硫酸强,则非金属性Cl>S,故正确;
⑤元素的非金属性越强,其氢化物的稳定性越强,气态氢化物的稳定性:H2S<HCl,则非金属性Cl>S,故正确;
故选C.
点评 本题考查元素非金属性强弱判断,明确元素非金属性与其氢化物的稳定性、单质的氧化性、最高价含氧酸的酸性等之间的关系即可解答,熟练掌握金属性、非金属性强弱比较方法,题目难度不大.

练习册系列答案
相关题目
17.短周期金属元素甲~戊在元素周期表的相对位置如表所示.下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 最高价氧化物对应的水化物的碱性:丙>丁>戊 | |
| B. | 金属性:甲>丙 | |
| C. | 原子半径:丙<丁<戊 | |
| D. | 最外层电子数:甲>乙 |
13.150℃时,将1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是( )
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |
10.下列关于元素的说法正确的是( )
| A. | 元素周期表中元素种类最多的周期是第6周期 | |
| B. | 第IA族元素均为碱金属元素 | |
| C. | 原子最外层电子数为2的元素一定位于第ⅡA族 | |
| D. | 元素周期表中元素种类最多的族是第Ⅷ族 |
14.若要使2mol CH4完全和Cl2发生取代反应,且生成的四种氯代物的物质的量相同,则所需Cl2的物质的量为( )
| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
15.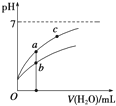 25℃时某些弱酸的电离平衡常数如表所示:
25℃时某些弱酸的电离平衡常数如表所示:
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如如图所示,下列说法正确的是( )
 25℃时某些弱酸的电离平衡常数如表所示:
25℃时某些弱酸的电离平衡常数如表所示:| CH3COOH | HClO | H2CO3 |
| K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 图象中a、c两点所处的溶液中$\frac{c({P}^{-})}{c(HP).c(O{H}^{-})}$相等(HP代表CH3COOH或HClO) | |
| C. | 图象中a点酸的浓度大于b点酸的浓度 | |
| D. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ |

