10.溴有两种同位素,在自然界中这两种同位素大约各占一半,已知溴的原子序数是35,原子量是80,则溴的两种同位素的中子数分别等于( )
| A. | 79、81 | B. | 45、46 | C. | 44、45 | D. | 44、46 |
9.下列各组中两种微粒所含电子数不相等的是( )
| A. | H3O+ 和OH- | B. | CO和N2 | C. | HNO2和NO2- | D. | CH3+ 和NH4+ |
8.X、Y、Z、M、W 为五种短周期元素.X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15,X 与 Z 可形成XZ2分子,Y 与 M 形成的气态化合物在标准状况下的密度为 0.76g/L;W 的质子数是 X、Y、Z、M四种元素质子数之和的1/2.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由Z、M两种元素形成化合物的分子式一定为M2Z | |
| D. | 由 X、Y、Z、M 四种元素形成的化合物可以既有离子键,又有共价键 |
6.根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A. | K层电子数为偶数的所有元素所在族的序数与该元素原子的K层电子数相等 | |
| B. | L层电子数为奇数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| C. | L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | M层电子数为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
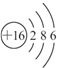
5.A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素名称:氮、硫、氟.
(2)B位于周期表中第三周期第ⅥA族.
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
| A | C | |
| B |
(2)B位于周期表中第三周期第ⅥA族.
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
4.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 | |
| B. | 已知As是第四周期、VA族的元素,故AsH3 的稳定性比NH3的稳定性强 | |
| C. | 已知Cs原子半径比Na的原子半径大,故Cs与水反应比Na与比反应更剧烈 | |
| D. | 已知Cl与Al处于同一周期,且Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小 |
3.原子序数为x的元素位于周期表中的第ⅡA族,则原子序数为x+1的元素不可能为( )
| A. | 第ⅢA族 | B. | 第ⅠA族 | C. | 镧系元素 | D. | 第ⅢB族 |
2.根据元素在周期表中的位置判断,下列元素中原子半径最小的是( )
| A. | 氧 | B. | 氮 | C. | 碳 | D. | 氟 |
1.下列关于碱金属的描述正确的是( )
0 166891 166899 166905 166909 166915 166917 166921 166927 166929 166935 166941 166945 166947 166951 166957 166959 166965 166969 166971 166975 166977 166981 166983 166985 166986 166987 166989 166990 166991 166993 166995 166999 167001 167005 167007 167011 167017 167019 167025 167029 167031 167035 167041 167047 167049 167055 167059 167061 167067 167071 167077 167085 203614
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属元素的单质硬度小、密度小、熔点低 | |
| C. | 在空气中加热均可生成多种氧化物 | |
| D. | 碱金属与水反应,均漂浮在水面上 |
 .
.