题目内容
18.下列各项表达正确的是( )| A. | 氯化氢分子的电子式: | B. | Ba(OH)2的电子式: | ||
| C. | 四氯化碳的电子式: | D. | N2的结构式::N≡N: |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.Ba(OH)2是离子化合物,由Ba2+离子和OH-离子构成;
C.四氯化碳中碳原子和氯原子均满足8电子稳定结构;
D.氮气的结构式中不需要标出未成对电子.
解答 解:A.HCl为共价化合物,分子中不存在阴阳离子,正确的氯化氢分子的电子式为 ,故A错误;
,故A错误;
B.Ba(OH)2是离子化合物,由Ba2+离子和OH-离子构成,Ba(OH)2的电子式为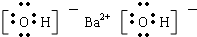 ,故B正确;
,故B正确;
C.四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为: ,故C错误;
,故C错误;
D.氮气分子中存在氮氮三键,结构式中不需要标出孤电子对,氮气的结构式为N≡N,故D错误;
故选B.
点评 本题主要考查的是电子式的书写,一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数;原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.

练习册系列答案
相关题目
8.下列有关实验操作说法中,正确的是( )
①用pH试纸测得氯水的pH为2
②仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可以鉴别pH相等的H2SO4和CH3COOH溶液
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体.
①用pH试纸测得氯水的pH为2
②仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可以鉴别pH相等的H2SO4和CH3COOH溶液
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体.
| A. | ①③⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④⑥ |
9.分类是化学学习和研究中的常用手段,下列分类依据和结论都正确的是( )
| A. | 浓盐酸、浓硫酸、浓硝酸均具有氧化性,都属于氧化性酸 | |
| B. | Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属于电解质 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属于离子化合物 | |
| D. | 金刚石、二氧化硅、碳化硅晶体中原子间均以共价键结合,都属于原子晶体 |
6.同族元素所形成的同一类型的化合物,其结构和性质往往相似.化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 该化合物中只含有共价键 |
13.有关晶体的结构如图所示,下列说法中错误的是( )


| A. | 在NaCl晶体中,距Na+最近的Cl-形成正八面体 | |
| B. | 该气态团簇分子的分子式为EF或FE | |
| C. | 在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻 | |
| D. | 在碘晶体中,碘分子的排列有两种不同的方向 |
3.把金属钠和金属钠在空气中的燃烧产物P分别加入到足量的水中,生成的气体在一定条件下恰好完全反应,则与水反应的金属钠与被氧化成P的金属钠的质量比为( )
| A. | 23:78 | B. | 2:1 | C. | 1:1 | D. | 46:78 |
10.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
| A. | 氧气 | B. | 二氧化硫 | ||
| C. | 二氧化氮和氧气 | D. | 二氧化氮和一氧化氮 |
2.海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其工艺流程如图所示:

已知:化学析出时用NaClO3作析出试剂,每生成0.05mol MnO2时消耗0.02mol NaClO3.根据以上工艺流程及信息,判断下列说法不正确的是( )

已知:化学析出时用NaClO3作析出试剂,每生成0.05mol MnO2时消耗0.02mol NaClO3.根据以上工艺流程及信息,判断下列说法不正确的是( )
| A. | 步骤Ⅰ中的试剂甲必须具有较强的还原性 | |
| B. | 步骤Ⅲ发生反应的离子方程式为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+ | |
| C. | 若用电解法,则MnO2将在阳极产生,电极反应式为Mn2+-2e-+2H2O═MnO2+4H+ | |
| D. | 测定步骤Ⅰ所得溶液中Mn2+的含量可采用先将Mn2+转化为Mn,然后再用0.1 mol•L-1HCl标准溶液滴定的方法 |