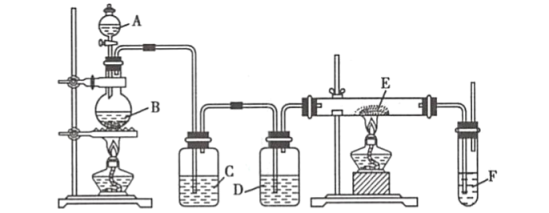
题目内容
【题目】碳氧化物的转化有重大用途,回答关于CO和![]() 的问题。
的问题。
![]() 已知:
已知:![]()
![]()
![]()
则![]() 的
的![]() ______
______![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示![]() 。
。
![]() 对于化学平衡
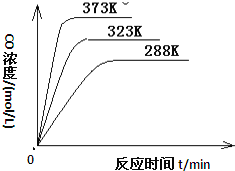
对于化学平衡![]() ,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
随着温度升高,______、______
![]() 某温度下,将
某温度下,将![]()
![]() 和足量碳充入3L的恒容密闭容器中,发生如下反应:
和足量碳充入3L的恒容密闭容器中,发生如下反应:![]() ,达到平衡时测得
,达到平衡时测得![]() 为平衡常数
为平衡常数![]() ,求平衡时
,求平衡时![]() 的转化率___________?
的转化率___________?![]() 写出计算过程
写出计算过程![]()
【答案】![]() 在同一时间CO的生成浓度大 反应的速率加快,达到平衡的时间缩短,温度升高平衡正向进行,正反应为吸热反应 20%
在同一时间CO的生成浓度大 反应的速率加快,达到平衡的时间缩短,温度升高平衡正向进行,正反应为吸热反应 20%
【解析】
(1)依据热化学方程式和盖斯定律计算得到热化学方程式;
(2)分析图象中曲线的变化和随温度变化的一氧化碳浓度结合平衡移动原理归纳操作的规律;
(3)依据化学平衡三段式列式计算,结合平衡常数计算转化率=![]() ×100%。
×100%。
(1)已知:![]()
![]()
![]()
![]()
依据盖斯定律![]() 得到,
得到,![]()
![]() 的
的![]() ;
;
![]() 对于化学平衡
对于化学平衡![]() ,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:随着温度升高一氧化碳浓度越大,反应速率越大,达到平衡的时间短,温度升高平衡正向进行,正反应为吸热反应;
,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:随着温度升高一氧化碳浓度越大,反应速率越大,达到平衡的时间短,温度升高平衡正向进行,正反应为吸热反应;
![]() 某温度下,将
某温度下,将![]()
![]() 和足量碳充入3L的恒容密闭容器中,发生如下反应,设消耗水蒸气浓度为x:
和足量碳充入3L的恒容密闭容器中,发生如下反应,设消耗水蒸气浓度为x:
![]() ,
,
起始量![]() 2 0 0
2 0 0
变化量![]() x xx
x xx
平衡量![]()
![]() xx
xx
达到平衡时测得![]() 为平衡常数
为平衡常数![]() ,
,![]()
由![]() ,
,
解得![]() ;
;
所以![]() 转化率为
转化率为![]()
![]() 。
。

【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,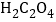 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快
【题目】用酸式滴定管准确移取25.00 mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000 molL-1的氢氧化钠溶液(指示剂为酚酞)滴定。滴定结果如下所示:
NaOH溶液起始读数 | NaOH终点读数 | |
第一次 | 0.10 mL | 12.70 mL |
第二次 | 0.00 mL | 12.40mL |
(1)准确配制0.2000 molL-1的氢氧化钠溶液250 mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的玻璃仪器有____。
(2)根据以上数据可以计算出盐酸的物质的量浓度为___molL-1。
(3)用0.2000 molL-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视______,直到滴定终点。
(4)达到滴定终点的标志是____。
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是____(填“偏高”或“偏低”或“不影响”)