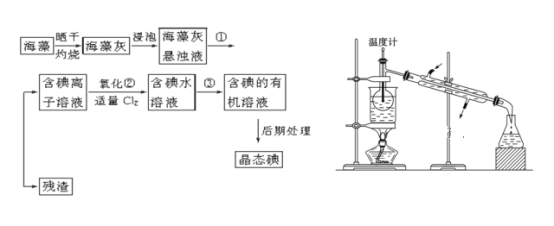
题目内容
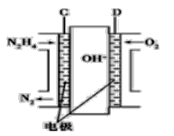
【题目】利用下列装置可以制备无水氯化铁。下列有关说法不正确的是( )
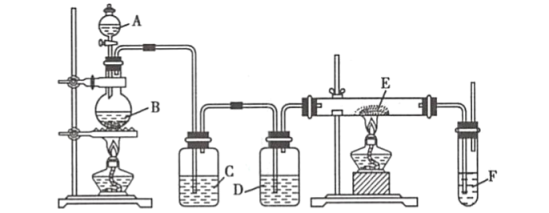
A.烧瓶B中制备氯气的反应物为二氧化锰和浓盐酸
B.装置C、D中分别盛有饱和食盐水和浓硫酸
C.装置D和装置E之间需要增加一个干燥装置,才能制得无水氯化铁
D.装置F的目的是吸收尾气
【答案】C
【解析】
由装置图可知圆底烧瓶中发生的是实验室制备氯气的反应,C中呈放的是饱和食盐水,吸收反应是挥发出的HCl,D中盛放的是浓硫酸,用于干燥氯气,E中放置的是铁粉,在双通管中生成无水氯化铁。
A. 实验室制备氯气用二氧化锰和浓盐酸,因此烧瓶B中制备氯气的反应物为二氧化锰和浓盐酸,A项正确,不符合题意;
B. C中呈放的是饱和食盐水,吸收反应时挥发出的HCl,D中盛放的是浓硫酸,用于干燥氯气,B项正确,不符合题意;
C. 装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁,C项错误,符合题意;
D. 氯气是大气污染物,因此装置F的目的是吸收反应中多余的氯气防止污染空气,D项正确;
答案选C。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目