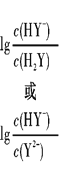题目内容
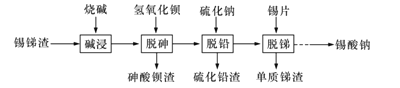
【题目】锡酸钠可用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下图所示:
请回答下列问題:
(1)Sn(IVA)、As(VA)、Sb(VA)三种元素中,Sn的原子序数为50,其原子结构示意图为_____,碱浸”时SnO2发生反应的化学方程式为___________________________。
(2)“碱浸”时,若Sn元素氧化物中SnO含量较高,工业上则加入NaNO3,其作用是_______。
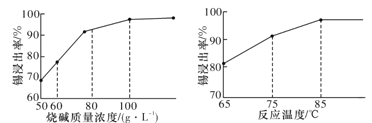
(3)从溶液中得到锡酸钠晶体的实验操作是_________、趁热过滤、洗涤、干燥。下图是“碱浸”实验的参数,请选择“碱浸”的合适条件_______。
(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时Na2SbO4发生的化学方程式为_____________________________。
【答案】 SnO2+2NaOH= Na2SnO3+H2O 把SnO氧化为SnO32— 蒸发结晶 100g·L-1烧碱浓度、温度85℃ PbO22- + S2- + 2H2O═PbS↓+ 4OH- 5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH
SnO2+2NaOH= Na2SnO3+H2O 把SnO氧化为SnO32— 蒸发结晶 100g·L-1烧碱浓度、温度85℃ PbO22- + S2- + 2H2O═PbS↓+ 4OH- 5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH
【解析】
由流程图可知,向锡锑渣中加入烧碱溶液,Sn、Sb、As、Pb的氧化物溶于氢氧化钠得到含有SnO32—、SbO43—、PbO22-、AsO43—的碱浸液,向碱浸液中加入氢氧化钡溶液,AsO43—与氢氧化钡反应生成砷酸钡沉淀过滤除去;向所得滤液中加入硫化钠溶液,PbO22-与硫化钠发生氧化还原反应生成硫化铅沉淀过滤除去;再向所得滤液中加入锡片,锡与SbO43—发生置换反应生成单质锑过滤除去,得到Na2SnO3溶液。
(1)Sn与碳同主族,Sn的原子序数为50,最外层电子数为4,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)NaNO3具有氧化性,能将SnO氧化,“碱浸”时,若SnO含量较高,工业上则加入NaNO3,其作用是把SnO氧化成SnO32-,故答案为:把SnO氧化为SnO32—;
(3)由图可知,烧碱浓度为100g·L-1,温度为85℃时,锡浸出率最高,故答案为:100g·L-1烧碱浓度、温度85℃;
(4)由题意可知,Na2PbO2溶液与硫化钠溶液发生氧化还原反应生成硫化铅沉淀和氢氧化钠,反应的离子方程式为PbO22- + S2- + 2H2O═PbS↓+ 4OH-,故答案为:PbO22- + S2- + 2H2O═PbS↓+ 4OH-;
(5)由流程图可知,“脱锑”时加入锡,锡与Na3SbO4溶液发生氧化还原反应生成Sb、Na2SnO3和NaOH,反应的化学方程式为5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH,故答案为:5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH。

【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
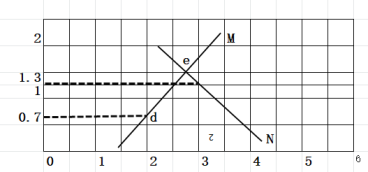
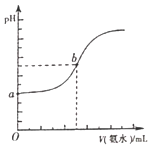
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。
【题目】A、B、C、D、E为短周期元素,在元素周期表中的相对位置如图所示。A、C两元素原子的核外电子数之和等于B原子的质子数,B原子的质子数和中子数相等。
A | C | |
D | B | E |
请回答下列问题:
(1)E元素位于元素周期表中第________周期第________族。
(2)几种元素中最高价氧化物对应的水化物的酸性最强的是(用化学式表示)____________________。
(3)C元素的原子结构示意图为________,用电子式表示C的氢化物的形成过程:____________。
(4)由元素A、C及氢元素形成的化合物中含有的化学键类型为____________________。