题目内容
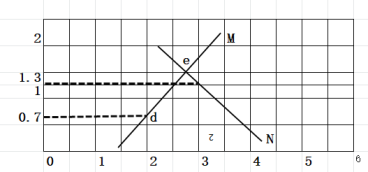
【题目】常温下向100mL 0.1mol·L-1的CH3COOH溶液中逐滴加入0.1mol·L-1的NaOH溶液,所得溶液的pH随加入NaOH溶液的体积V的关系中不正确的是
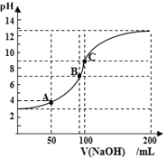
A. A点表示的溶液:c(CH3COO-)>c(Na+)
B. A点溶液中:c(CH3COO-)-c(CH3COOH) =2×(10-4-10-10)mol·L-1
C. B点表示CH3COOH和NaOH恰好反应完全
D. C点溶液促进水的电离
【答案】C
【解析】
A. 依据电荷守恒规律作答;
B. 遵循电荷守恒和物料守恒;
C. B点的pH=7,醋酸为弱酸,若完全反应生成的醋酸钠显碱性,与图像不符;
D. 醋酸钠会发生水解,促进水的电离。
A. A点溶液pH=4,说明溶液中c(H+)>c(OH-),根据电荷守恒规律c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-)可知,c(CH3COO-)>c(Na+),A项正确;
B. 任何电解质溶液中都存在电荷守恒和物料守恒,醋酸和NaOH浓度相等,醋酸体积是NaOH的二倍,所以存在2c(Na+)=c(CH3COOH)+c(CH3COO-),根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(CH3COO-)、根据物料守恒得2c(Na+)=c(CH3COOH)+c(CH3COO-),所以得c(CH3COO-)-c(CH3COOH)= 2c(OH-)-2c(H+)═2×(10-4-10-10)mol·L-1,选项B正确;
C. B点pH=7,说明溶液显中性,因醋酸为弱酸,若醋酸与氢氧化钠恰好完全反应,则生成的醋酸钠会因发生水解使溶液显碱性,所以B点处醋酸应过量,C项错误;
D. 向100mL 0.1mol·L-1的CH3COOH溶液中逐滴加入0.1mol·L-1的NaOH溶液时,C点氢氧化钠的体积为100mL,则CH3COOH和NaOH恰好反应完全,溶液的溶质为CH3COONa,因其会发生水解,所以会促进水的电离,D项正确;
答案选C。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案