题目内容
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH30H(g)△H1
反应Ⅱ:C02(g)+3H2(g)?CH30H(g)+H20(g)△H2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”).
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
由表中数据判断△H1 0(填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择).
(2)已知在常温常压下:
①2CH30H(1)+302(g)=2C02(g)+4H20(g)△H=-1275.6kJ/mol
②2C0(g)+02(g)=2C02(g)△H=-566.0kJ/mol
③H20(g)=H20(1)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH30H(g)△H1
反应Ⅱ:C02(g)+3H2(g)?CH30H(g)+H20(g)△H2
①上述反应符合“原子经济”原则的是
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为
(2)已知在常温常压下:
①2CH30H(1)+302(g)=2C02(g)+4H20(g)△H=-1275.6kJ/mol
②2C0(g)+02(g)=2C02(g)△H=-566.0kJ/mol
③H20(g)=H20(1)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
考点:化学平衡的计算,热化学方程式,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)①“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
②升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
③根据平衡浓度计算出平衡常数来确定温度以及转化率的定义可以算出转化率;
(2)根据热化学方程式利用盖斯定律计算反应热并书写热化学方程式.
②升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
③根据平衡浓度计算出平衡常数来确定温度以及转化率的定义可以算出转化率;
(2)根据热化学方程式利用盖斯定律计算反应热并书写热化学方程式.
解答:
解:(1)①根据原子经济知,Ⅰ没有副产物,符合原子经济理念,Ⅱ中有副产物,不符合原子经济理念,
故答案为:I;
②升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
③CO(g)+2H2(g) ?CH3OH(g)
?CH3OH(g)
反应开 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
CO的转化率为
×100%=80%;
平衡常数K=
=2.04,所以是250℃;
故答案为:80%;250℃;
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
利用盖斯定律将
+③可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
故答案为:I;
②升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
③CO(g)+2H2(g)
 ?CH3OH(g)
?CH3OH(g)反应开 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
CO的转化率为
| 0.8mol/L |
| 1mol/L |
平衡常数K=
| 0.8mol/L |
| 0.2mol/L.(1.4mol/L)2 |
故答案为:80%;250℃;
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
利用盖斯定律将
| ①-② |
| 2 |
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
点评:本题考查了原子经济、影响化学平衡移动的因素、平衡状态的判断、转化率及化学平衡常数的计算、热化学方程式的书写等知识点,中等难度.

练习册系列答案
相关题目
下列依据相关实验得出的结论正确的是( )
| A、向漂白粉上加入较浓的盐酸,产生的气体不能使湿润淀粉碘化钾试纸变蓝,说明该漂白粉已经失效 |
| B、向某溶液中加入稀硝酸再滴入Ba(NO3)2溶液产生白色沉淀,该溶液一定含SO42- |
| C、向FeCl2溶液中滴加少量KSCN溶液变血红色,说明FeCl2完全被氧化成FeCl3 |
| D、向浓度均为0.1mol?L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
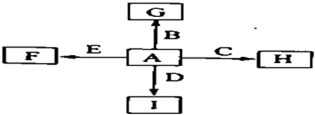 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应: