题目内容
在557℃时密闭容器中进行反应:CO(g)+H2O(g)?H2(g)+CO2(g).若CO起始浓度为2mol/L,水蒸气的起始浓度为3mol/L,达到平衡后,测得CO2的浓度为1.2mol/L.
(1)求在该温度下反应的平衡常数K及此状态下CO的平衡转化率.
(2)当起始投料C0(CO)=2mol/L,C0(H2O)=2mol/L时CO的平衡转化率.
(1)求在该温度下反应的平衡常数K及此状态下CO的平衡转化率.
(2)当起始投料C0(CO)=2mol/L,C0(H2O)=2mol/L时CO的平衡转化率.
考点:化学平衡的计算
专题:化学平衡专题
分析:利用三段式计算平衡时各组分的平衡浓度,
(1)将平衡浓度代入平衡常数表达式k=
计算;根据转化率=
×100%计算;
(2)根据温度不变平衡常数不变,根据平衡常数计算平衡时的浓度再求得转化率.
(1)将平衡浓度代入平衡常数表达式k=
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 浓度变化量 |
| 起始浓度 |
(2)根据温度不变平衡常数不变,根据平衡常数计算平衡时的浓度再求得转化率.
解答:
解:(1)CO起始浓度为2mol?L-1,水蒸气的起始浓度为3mol?L-1,达到平衡后,CO2平衡浓度为1.2mol?L-1,则:
CO(g)+H2O(g) ?H2(g)+CO2(g)
?H2(g)+CO2(g)
开始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
CO的转化率=
×100%=60%,
该温度下平衡常数k=
=1,
答:该温度下,该反应的平衡常数为1,CO转化率为60%;
(2)设CO转化的浓度为x
CO(g)+H2O(g) ?H2(g)+CO2(g)
?H2(g)+CO2(g)
开始(mol/L):2 2 0 0
变化(mol/L):x x x x
平衡(mol/L):2-x 2-x x x
由于温度不变化学平衡常数不变,则有K=
=1,解得x=1,故CO转化率为
×100%=50%,
答:CO的平衡转化率为50%.
CO(g)+H2O(g)
 ?H2(g)+CO2(g)
?H2(g)+CO2(g)开始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
CO的转化率=
| 1.2mol/L |
| 2mol/L |
该温度下平衡常数k=
| 1.2×1.2 |
| 0.8×1.8 |
答:该温度下,该反应的平衡常数为1,CO转化率为60%;
(2)设CO转化的浓度为x
CO(g)+H2O(g)
 ?H2(g)+CO2(g)
?H2(g)+CO2(g)开始(mol/L):2 2 0 0
变化(mol/L):x x x x
平衡(mol/L):2-x 2-x x x
由于温度不变化学平衡常数不变,则有K=
| x2 |
| (2-x)2 |
| x |
| 2 |
答:CO的平衡转化率为50%.
点评:本题考查化学平衡的有关计算、平衡常数计算,比较基础,注意三段式解题法的利用.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、Fe3O4溶液稀盐酸:Fe3O4+8H+═3Fe3++4H2O |
| C、用烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O |
| D、向硫酸亚铁溶液中加入用硫酸酸化的H2O2溶液Fe2++H2O2+2H+═Fe3++4H2O |
一定条件下,下列各组物质混合后,两种反应物最有可能恰好反应完的是( )
| A、浓盐酸和MnO2制Cl2 |
| B、铜和浓硫酸 |
| C、铜和浓硝酸 |
| D、大理石块和硫酸 |
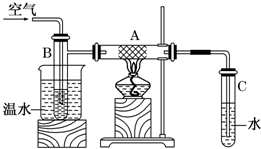 如图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.
如图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.
 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL 0.5mol/L的盐酸与50mL.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL 0.5mol/L的盐酸与50mL.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: