题目内容
【题目】工业上采用高温活性炭催化CO与C12合成光气(COCl2))。
(1)COCl2 中的原子最外层都达到 8电子稳定结构,光气分子的电子式为_____。
(2)工业上利用天然气(CH4)与CO2 进行高温重整制备CO的反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.3 kJ/mol。已知:C—H、C≡O、H—H键的键能依次为413 kJ·mol-1、1076 kJ·mol-1、436 kJ·mol-1,则 C=O键的键能为____kJ·mol-1。
(3)光气为窒息性毒剂,极易水解生成氯化氢,泄露后可用水雾吸收,化学方程式为:_______。
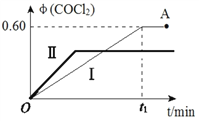
(4)某温度下,在2L恒容密闭容器中充入 2 mol CO(g)、2 mol Cl2(g)和适量的活性炭,发生反应:Cl2(g)+CO(g)![]() COCl2(g) ΔH=-108 kJ·mol-1,测得在混合气中COCl2的体积分数φ(COCl2)和时间t 的关系如图曲线Ⅰ所示。
COCl2(g) ΔH=-108 kJ·mol-1,测得在混合气中COCl2的体积分数φ(COCl2)和时间t 的关系如图曲线Ⅰ所示。
①下列情况不能表明该反应达到平衡状态的是_______(填字母标号)。
A.CO的体积分数不改变
B.Cl2的消耗速率与COCl2的生成速率相等
C.体系中![]() 不改变
不改变
D.混合气体的平均相对分子质量不再变化
②按曲线Ⅰ,平衡常数K=____。A点时,向容器中加入等物质的量CO和Cl2,再次达到平衡时,光气的体积分数会 ______(填“增大”、 “减小”或“不变”。
③曲线Ⅱ相对曲线Ⅰ改变的条件可能是_______(填字母标号)。
A.恒容通入惰性气体 B.通入 CO
C.增大压强 D.升高温度
【答案】 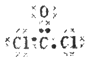 809.65 COC12+H2O=HC1+CO2 BC 12L/mol 增大 D
809.65 COC12+H2O=HC1+CO2 BC 12L/mol 增大 D
【解析】(1)COCl2中的原子最外层都达到 8电子稳定结构,光气分子的电子式为![]() ;(2)根据化学反应的热效应等于反应物键能和减去生成物的键能和,设C=O键的键能为xkJ/mol,则有:413 kJ·mol-1×4+2x -1076 kJ·mol-1×2-2×436 kJ·mol-1=+247.3 kJ/mol,解得x=809.65;(3)光气为窒息性毒剂,极易水解生成氯化氢,泄露后可用水雾吸收,化学方程式为:COC12+H2O=HC1+CO2;(4)①A.体系中各组分的百分含量保持不变,说明反应达平衡了,故CO的体积分数不改变,反应达到平衡状态;B.Cl2的消耗速率与COCl2的生成速率都是指正反应速率,无法说明正逆反应速率相等,反应不一定达到平衡状态;C.CO和Cl2都是反应物,物质的量之比总为1:1,即体系中
;(2)根据化学反应的热效应等于反应物键能和减去生成物的键能和,设C=O键的键能为xkJ/mol,则有:413 kJ·mol-1×4+2x -1076 kJ·mol-1×2-2×436 kJ·mol-1=+247.3 kJ/mol,解得x=809.65;(3)光气为窒息性毒剂,极易水解生成氯化氢,泄露后可用水雾吸收,化学方程式为:COC12+H2O=HC1+CO2;(4)①A.体系中各组分的百分含量保持不变,说明反应达平衡了,故CO的体积分数不改变,反应达到平衡状态;B.Cl2的消耗速率与COCl2的生成速率都是指正反应速率,无法说明正逆反应速率相等,反应不一定达到平衡状态;C.CO和Cl2都是反应物,物质的量之比总为1:1,即体系中![]() 保持恒定不变,故比值不变不能说明反应达到平衡;D.反应的气体的总质量不变,而反应为气体体积变化的反应,若体积不变则气体的物质的量不变,混合气体的平均相对分子质量不再变化,则反应达平衡状态;答案选BC;②按曲线Ⅰ,设的转化率为x,则:
保持恒定不变,故比值不变不能说明反应达到平衡;D.反应的气体的总质量不变,而反应为气体体积变化的反应,若体积不变则气体的物质的量不变,混合气体的平均相对分子质量不再变化,则反应达平衡状态;答案选BC;②按曲线Ⅰ,设的转化率为x,则:
Cl2(g)+CO(g)![]() COCl2(g)
COCl2(g)
起始浓度(mol/L) 1 1 0
改变浓度(mol/L) x x x
平衡浓度(mol/L) 1-x 1-x x
平衡时COCl2的体积分数φ(COCl2)为60%,则![]() =60%,解得x=0.75,K=
=60%,解得x=0.75,K=![]() =
=![]() =12L/mol;向容器中加入等物质的量CO和Cl2,恒容条件下,相当于增大压强,平衡向气体体积缩小的正反应方向移动,再次达到平衡时,光气的体积分数会增大;③对比曲线Ⅱ和曲线Ⅰ可知,曲线Ⅱ反应速率快,平衡时COCl2的体积分数φ(COCl2)小则平衡逆向移动。A.恒容通入惰性气体,各参与反应的气体的浓度不变,反应速率不变,平衡不移动,选项A错误;B.通入 CO,反应物的浓度增大,反应速率增大,平衡正向移动,选项B错误;C.增大压强,反应速率增大,平衡正向移动,选项C错误;D.升高温度,反应速率增大,平衡向吸热反应的逆反应方向移动,选项D正确。答案选D。
=12L/mol;向容器中加入等物质的量CO和Cl2,恒容条件下,相当于增大压强,平衡向气体体积缩小的正反应方向移动,再次达到平衡时,光气的体积分数会增大;③对比曲线Ⅱ和曲线Ⅰ可知,曲线Ⅱ反应速率快,平衡时COCl2的体积分数φ(COCl2)小则平衡逆向移动。A.恒容通入惰性气体,各参与反应的气体的浓度不变,反应速率不变,平衡不移动,选项A错误;B.通入 CO,反应物的浓度增大,反应速率增大,平衡正向移动,选项B错误;C.增大压强,反应速率增大,平衡正向移动,选项C错误;D.升高温度,反应速率增大,平衡向吸热反应的逆反应方向移动,选项D正确。答案选D。

【题目】已知:I2+2S2O32-=S4O62-+2I-
相关物质的溶度积常数见下表:
物质 | Cu(OH)2蓝色 | Fe(OH)3红褐 | CuCl白色 | CuI白色 |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.02×10-6 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3 , 为得到纯净的CuCl2·2H2O晶体,加入 , 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2 , 原因是(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
可选用作滴定指示剂,滴定终点的现象是。
CuCl2溶液与KI反应的离子方程式为。


