题目内容
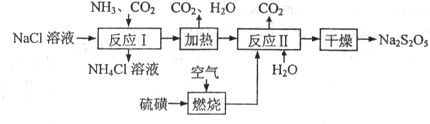
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
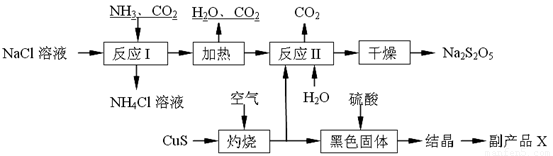
已知:反应Ⅱ包含2NaHSO3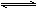 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是: ;可循环利用的物质是:_________和_______。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。
【答案】
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O (2分)
2NH3↑+CaCl2+2H2O (2分)
(2)2CuS+3O2 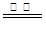 2CuO+2SO2
(2分)
2CuO+2SO2
(2分)
(3) S2O52-+2H+=2SO2↑+H2O (2分)
(4) CuSO4•5H2O (2分) CO2、H2O (各2分,共4分) (5)2∶1 (2分)
【解析】
试题分析:⑴实验室中制备氨气是用固体的氢氧化钙和固体的氯化铵来制备。(2)硫化铜灼烧一定生成氧化铜和二氧化硫。(3)根椐提示可知生成二氧化硫和水。(4)从生产过程可以看出是硫酸铜晶体;从图示中可以看出二氧化碳和水可以再次利用;反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠:Na2CO3+2SO2=2NaHSO3+CO2;因此气体与固体的物质的量之比为:2∶1
考点:考查焦亚硫酸钠的制备。

练习册系列答案
相关题目


 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。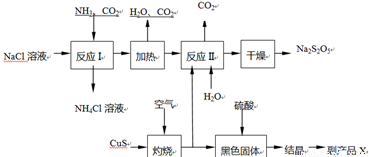
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。