题目内容
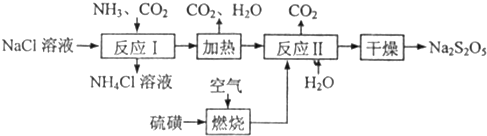
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.其制备工艺流程如下:
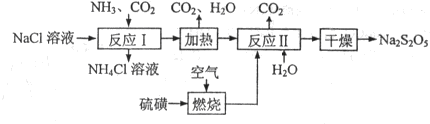
已知:反应Ⅱ包含2NaHSO3
Na2S2O5+H2O等多步反应.
(1)反应I的化学方程式为
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是
(3)反应Ⅱ中需控制参加反应的气体与固体的物质的量之比接近
(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为

已知:反应Ⅱ包含2NaHSO3
| 加热 |
(1)反应I的化学方程式为
CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl
CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl
,反应Ⅰ进行时应先通入NH3
NH3
气体.(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是
增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率
增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率
.在上述工艺流程中可循环使用的物质是CO2、H2O
CO2、H2O
.(3)反应Ⅱ中需控制参加反应的气体与固体的物质的量之比接近
2:1
2:1
,若气体量不足,则会导致Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低
Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低
.(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为
S2O52-+2H+=2SO2↑+H2O
S2O52-+2H+=2SO2↑+H2O
.分析:该原理为:反应Ⅰ为生成NaHCO3,加热生成Na2CO3,在反应Ⅱ中二氧化硫与碳酸钠反应生成NaHSO3与二氧化碳,加热NaHSO3生成Na2S2O5.
(1)工艺流程可知,反应Ⅰ为生成NaHCO3,氯化钠溶液通入氨气、二氧化碳生成碳酸氢钠与氯化铵,反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出;
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;
反应需要的物质,在其它的反应中又生成该物质,该物质可以循环利用,结合方式的反应判断;
(3)反应Ⅱ中发生反应Na2CO3+H2O+SO2=2NaHSO3+CO2↑,2NaHSO3
Na2S2O5+H2O,根据碳酸钠与二氧化硫能完全反应判断,二者物质的量关系;
若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加;
(4)Na2S2O5与稀硫酸反应生成SO2,反应中S元素的化合价未发生变化,同时生成硫酸钠与水.
(1)工艺流程可知,反应Ⅰ为生成NaHCO3,氯化钠溶液通入氨气、二氧化碳生成碳酸氢钠与氯化铵,反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出;
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;
反应需要的物质,在其它的反应中又生成该物质,该物质可以循环利用,结合方式的反应判断;
(3)反应Ⅱ中发生反应Na2CO3+H2O+SO2=2NaHSO3+CO2↑,2NaHSO3
| 加热 |
若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加;
(4)Na2S2O5与稀硫酸反应生成SO2,反应中S元素的化合价未发生变化,同时生成硫酸钠与水.
解答:解:该原理为:反应Ⅰ为生成NaHCO3,加热生成Na2CO3,在反应Ⅱ中二氧化硫与碳酸钠反应生成NaHSO3与二氧化碳,加热NaHSO3生成Na2S2O5.
(1)工艺流程可知,反应Ⅰ为生成NaHCO3,氯化钠溶液通入氨气、二氧化碳生成碳酸氢钠与氯化铵,反应方程式为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;
反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出,
故答案为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;NH3;
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;
由转化关系可知,反应中需要CO2、H2O,其它反应又生成的CO2、H2O,故CO2、H2O可以重复利用;
故答案为:增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;CO2、H2O;
(3)反应Ⅱ中发生反应Na2CO3+H2O+2SO2=2NaHSO3+CO2↑,2NaHSO3
Na2S2O5+H2O,故SO2与Na2CO3的物质的量之比接近
2:1恰好完全反应,若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低;
故答案为:2:1;Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低;
(4)Na2S2O5与稀硫酸反应生成SO2,反应中S元素的化合价未发生变化,同时生成硫酸钠与水,反应离子方程式为:S2O52-+2H+=2SO2↑+H2O,
故答案为:S2O52-+2H+=2SO2↑+H2O.
(1)工艺流程可知,反应Ⅰ为生成NaHCO3,氯化钠溶液通入氨气、二氧化碳生成碳酸氢钠与氯化铵,反应方程式为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;
反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出,
故答案为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;NH3;
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;
由转化关系可知,反应中需要CO2、H2O,其它反应又生成的CO2、H2O,故CO2、H2O可以重复利用;
故答案为:增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;CO2、H2O;
(3)反应Ⅱ中发生反应Na2CO3+H2O+2SO2=2NaHSO3+CO2↑,2NaHSO3
| 加热 |
2:1恰好完全反应,若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低;
故答案为:2:1;Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低;
(4)Na2S2O5与稀硫酸反应生成SO2,反应中S元素的化合价未发生变化,同时生成硫酸钠与水,反应离子方程式为:S2O52-+2H+=2SO2↑+H2O,
故答案为:S2O52-+2H+=2SO2↑+H2O.
点评:本题以制备焦亚硫酸钠为载体,考查学生对于工艺流程原理的理解、对操作与反应条件可知的理解,侯德榜制碱法、S与C等元素化合物的性质与转化、常用化学用语书写等,知识比较陌生,难度较大,理解制备原理是关键,需要学生具备扎实的基础与综合运用能力.

练习册系列答案
相关题目
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。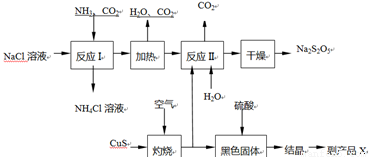
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。