题目内容
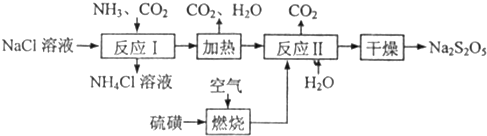
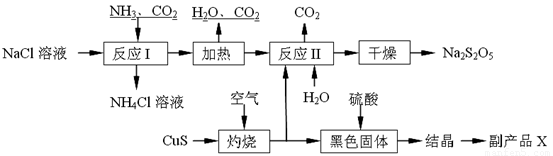
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
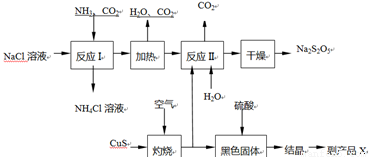
已知:反应Ⅱ包含2NaHSO3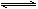 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是: ;可循环利用的物质是:_____________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。
(6)检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水 ④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
(2分)
2NH3↑+CaCl2+2H2O
(2分)
(2)2CuS+3O2  2CuO+2SO2
(2分)
2CuO+2SO2
(2分)
(3)S2O52-+2H+=2SO2↑+H2O (2分)
(4)CuSO4•5H2O (2分) CO2、H2O (2分)
(5)2∶1 (3分)
(6)①③⑥或①②③⑥ (3分)
【解析】
试题分析:(1)实验室采取加热氯化铵和氢氧化钙来制取氨气,方程式为:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)CuS中S是-2价,有较强还原性,在空气中焙烧容易被氧化为SO2,所以发生的焙烧反应方程式为:2CuS+3O2  2CuO+2SO2
2CuO+2SO2
(3)Na2S2O5 中S的化合价为+4价,所以加硫酸放出SO2气体的过程中没有发生氧化还原反应,所以反应方程式为:S2O52-+2H+=2SO2↑+H2O
(4)因为CuS在空气中焙烧后得到的黑色固体是CuO,所以加入硫酸后反应生成了CuSO4 ,所以结晶后可得的副产品为CuSO4•5H2O晶体。
(5)反应Ⅰ为侯氏制碱法制取NaHCO3,制得的NaHCO3又加热得到Na2CO3,所以制取产品Na2S2O5 的反应物为Na2CO3和SO2,由产物化学式Na2S2O5 可知Na :S =1:1,所以控制n(Na2CO3):n(SO2)=1:2。
(6)因为Na2S2O5 具有还原性,所以加硫酸容易产生SO2气体,也能使澄清石灰水变浑浊。所以要排除SO2的干扰应该先加强氧化剂酸性高锰酸钾,然后加硫酸,若存在杂质碳酸钠,则会产生无色气体(不能使品红溶液褪色),通入澄清石灰水中,若石灰水变浑浊,则说明有碳酸钠杂质。
考点:本题考查的是化工生产流程。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。