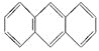
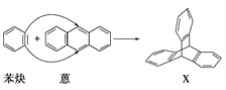
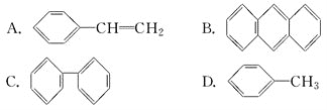
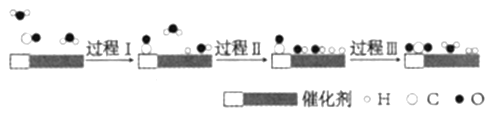
题目内容
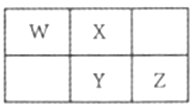
【题目】2019年是门捷列夫提出元素周期表150周年,联合国将2019年定为“国际化学元素周期表年”。已知短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法正确的是( )
A. W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
B. 在元素周期表中,117号元素与Z元素位于同一主族
C. 氧化物对应水化物的酸性:Z>Y
D. W、X、Y、Z四种元素对应的单质的沸点:W<X<Y<Z
【答案】B
【解析】
令X的最外层电子数为a,则Y的最外层电子数为a,W的最外层电子数为a-1,Z的最外层电子数为a+1,四种元素最外层电子数之和等于24,即a-1+a+a+a+1=24,得出a=6,即W为N,X为O,Y为S,Z为Cl,据此分析;
A、W的氢化物是NH3,Z的氢化物是HCl,二者反应所得产物是氯化铵,氯化铵是强酸弱碱盐,水溶液呈酸性,故A错误;
B、117号元素位于第七周期ⅦA族,与Cl元素属于同一主族,故B正确;
C、Cl的氧化物对应水化物可以是HClO4,也可以是HClO,HClO4是强酸,HClO是弱酸,S的氧化物可以是H2SO3,也可以是H2SO4,H2SO3为弱酸,H2SO4为强酸,故C错误;
D、硫单质为固体,其余为气体,因此硫单质的沸点最高,故D错误;
答案选B。

【题目】硫代硫酸钠晶体(![]() ,
,![]() )可用作还原剂。回答下列问题:
)可用作还原剂。回答下列问题:
(1)已知:![]() ,
,![]() 都是难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
都是难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀![]() 、
、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液
溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③取少量溶液溶于盐酸 | ④出现乳黄色浑浊,_____ |
⑤静置,________ | ⑥_______ |
(2)利用![]() 作为标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
作为标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制;称取1.270g纯净的![]() ,在盛有KI溶液的____(填仪器名称,下同)中溶解(反应为
,在盛有KI溶液的____(填仪器名称,下同)中溶解(反应为![]() ,
,![]() 能够充分反应),完全溶解后,全部转移至100 mL的____中,加蒸馏水至刻度线,此时
能够充分反应),完全溶解后,全部转移至100 mL的____中,加蒸馏水至刻度线,此时![]() 溶液的物质的量浓度为____
溶液的物质的量浓度为____![]() ;再取
;再取![]() 样品配制成溶液,备用。
样品配制成溶液,备用。
②滴定:利用发生反应:![]() ,对上述配制的
,对上述配制的![]() 溶液进行滴定,终点时消耗标准溶液20.00 mL,则样品纯度为___%(保留1位小数。
溶液进行滴定,终点时消耗标准溶液20.00 mL,则样品纯度为___%(保留1位小数。