题目内容
【题目】把镁条直接投入到盛有盐酸的敞口容器中,产生H2的速率如图所示,
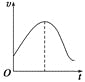
在下列因素中,影响反应速率的因素是
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④B. ③④C. ①②③D. ②③
【答案】C
【解析】
镁条与盐酸反应离子方程式为Mg+2H+═Mg2++H2↑。由图可知,产生H2速率先增大后减小。
①开始盐酸的浓度较大,反应速率快,但随反应的进行,浓度减小,则反应速率减小,故①正确;
②由反应可知Mg参加反应,开始接触面积大,反应速率快,但随反应的进行,接触面积减小,则反应速率减小,故②正确;
③因该反应为放热反应,放热使温度升高,则反应速率加快,故③正确;
④因Cl-实质上不参加反应,Cl-的浓度增大或减小都不影响化学反应速率,且该反应中Cl-的浓度不变,故④错误;故C正确。
答案选C。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目