题目内容
【题目】下列氧化还原反应方程式, 所标电子转移方向与数目错误的是( )
A.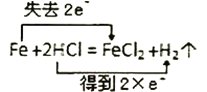 B.
B.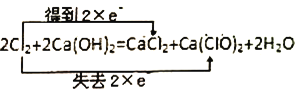
C.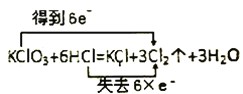 D.
D.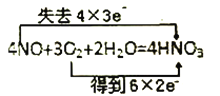
【答案】C
【解析】
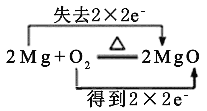
A.铁元素由0价升高到+2价,失去2个电子,氢元素由+1价降低到0价,得到两个电子,A选项正确。
B.氯元素由0价升高到Ca(ClO)2中氯元素的+1价,失去两个电子,同时氯元素由0价降低至氯化钙中的-1价得到两个电子,B选项正确。
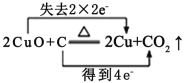
C.KClO3中Cl元素由+5价降低至0价,得到5个电子,HCl中氯元素由-1价升高到0价,失去5个电子,C选项电子转移的数目错误,C选项错误。
D.NO中N元素由+2价升高到+5价,失去3×4个电子,O元素由0价降低至-2价,得到6×2个电子,得失电子守恒且电子转移方向与数目正确,D选项正确。
故答案选C。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目