题目内容
9.下列说法不正确的是( )| A. | 氧气和臭氧互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,所以${\;}_{2}^{3}$He具有较强的金属性 |
分析 A.同种元素形成的不同单质互为同素异形体;
B.分子式相同,结构不同的化合物互称为同分异构体;
C.质子数相同中子数不同的原子互称同位素;
D.${\;}_{2}^{4}$He的最外层电子数为2,为稳定结构.
解答 解:A.O2和O3是氧元素组成的结构不同的单质,互为同素异形体,故A正确;
B.CH3-CH2OH和 CH3-O-CH3分子式相同,结构不同,为同分异构体,故B正确;
C.${\;}_{2}^{3}$He和${\;}_{2}^{4}$He中子数不同,是氢元素的不同原子,互为同位素,故C正确;
D.${\;}_{2}^{4}$He的最外层电子数为2,难以失去电子,金属性较弱,故D错误.
故选D.
点评 本题主要考查了同系物、同分异构体、同位素、同素异形体的区别,难度不大,注意把握概念的内涵与外延.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
5.某实验小组的同学想用碳酸钠溶液与饱和石灰水反应来制取氢氧化钠.
(1)该复分解反应发生的理由是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,有沉淀生成,该反应能够发生;
(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.
猜想一:只含NaOH;
猜想二:含有NaOH和Na2CO3;
猜想三:含有NaOH和Ca(OH)2.
(3)为了验证猜想一成立,请你根据可选用的试剂,完成实验设计方案并填写以下表格.可选试剂:NaCl溶液、稀盐酸、Na2CO3溶液
(1)该复分解反应发生的理由是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,有沉淀生成,该反应能够发生;
(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.
猜想一:只含NaOH;
猜想二:含有NaOH和Na2CO3;
猜想三:含有NaOH和Ca(OH)2.
(3)为了验证猜想一成立,请你根据可选用的试剂,完成实验设计方案并填写以下表格.可选试剂:NaCl溶液、稀盐酸、Na2CO3溶液
| 实验步骤 | 实验操作 | 预期现象及结论 |
| 1 | 取少量所得溶液于试管中, 再滴入几滴稀盐酸 | 若无气泡产生,证明原溶液中不含有Na2CO3 |
| 2 | 另取少量所得溶液于试管中, 再滴入几滴Na2CO3溶液 | 若无沉淀产生,结合步骤1,猜想一成立. |
20.下列配合物的水溶液中加入硝酸银不能生成沉淀的是( )
| A. | [Co(NH3)4 Cl2]Cl | B. | [Cu(NH3)4]Cl2 | C. | [Co(NH3)6]Cl3 | D. | [Co(NH3)3 Cl3] |
17.用a、b、c、d四种金属进行如下图所示的实验,部分反应现象如下表所示,由此判断四种金属的活动性由强到弱的顺序是( )
| 实验装置 | 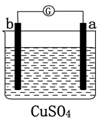 | 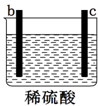 | 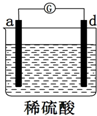 |
| 部分实验现象 | a极质量减少b极质量增加 | b极有气体产生c极无变化 | 电流从a极流向d极 |
| A. | abcd | B. | bcda | C. | dabc | D. | abdc |
4.填写下列表格(电解质溶液PH的变化一栏填写“变大”、“变小”或“不变”)
| 化学电源名称 | 正极反应式 | 负极反应式 | 电解质溶液pH的变化 |
| 碱性氢氧燃料电池 | O2+2H2O+4e-=4OH- | 此空不用填写 | 变小 |
| 碱性甲烷燃料电池 | 此空不用填写 | CH4+8e-+10OH-=CO32-+7H2O | 变小 |
14.下列关于钠元素的说法正确的是( )
| A. | 小苏打可以治疗胃酸过多,是利用了小苏打的酸性 | |
| B. | 与足量等浓度盐酸溶液反应的速率:NaHCO3<Na2CO3 | |
| C. | 久置在空气中的钠最后变成碳酸钠晶体 | |
| D. | 某未知样品灼烧时能使火焰呈黄色,说明该样品中肯定含有钠元素 |
1.在现代化学分析测试中,常借助一些仪器来分析化学物质的组成.下列有关说法不正确的是( )
| A. | 用红外光谱仪确定物质中是否存在Na+、K+、Cu2+等离子 | |
| B. | 用元素分析仪确定物质中是否含有C、H、O、N、S等 | |
| C. | 用原子吸收光谱确定物质中含有哪些金属元素 | |
| D. | 用pH计来测量溶液的酸碱性 |
 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到). AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)
AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)