题目内容
10.用36.5%(ρ=1.18g/mL)的浓盐酸配制100mL 2mol/L的盐酸.(1)经计算,需用浓盐酸的体积16.95mL
(2)在此实验中,使用的主要仪器有下列的CDEFG
A.50mL 容量瓶 B.天平 C.酸式滴定管 D.烧杯 E.胶头滴管 F.100mL 容量瓶 G.玻璃棒.
分析 (1)先计算出浓盐酸的物质的量浓度c=$\frac{1000ρω}{M}$,然后根据溶液稀释前后物质的量不变计算所需浓盐酸的体积;
(2)根据配制一定浓度溶液步骤选用仪器.
解答 解:(1)浓盐酸的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8mol/L,
设所需浓盐酸的体积为V,则有V×11.8mol/L=O.1L×2mol/L,则V=$\frac{2mol/L×0.1L}{11.8mol/L}$=O.01695L=16.95mL,
故答案为:16.95mL;
(2)实验操作的步骤有计算、称量、溶解、恢复室温、移液、洗涤、定容、摇匀等操作,用量筒量(或酸式滴定管)取浓盐酸,在烧杯中稀释,并用玻璃棒搅拌,恢复室温后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯和玻璃棒2~3次,并将洗涤液移入容量瓶中,继续当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加水到凹液面与刻度线水平相切,盖好瓶塞,反复颠倒上下摇匀,移入试剂瓶贴标签贮存,
所以需要的仪器为:量筒(或酸式滴定管)、烧杯、玻璃棒、100mL容量瓶、胶头滴管,即:CDEFG,
故答案为:CDEFG.
点评 本题考查了物质的量浓度的计算与应用,题目浓度中等,注意掌握配制一定物质的量浓度的溶液的步骤,明确物质的量浓度的计算方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
1.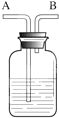 如图所示装置有洗气、储气等用途.在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水.以下说法不正确的是( )
如图所示装置有洗气、储气等用途.在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水.以下说法不正确的是( )
 如图所示装置有洗气、储气等用途.在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水.以下说法不正确的是( )
如图所示装置有洗气、储气等用途.在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水.以下说法不正确的是( )| A. | 导管B连接供给氧气的钢瓶 | |
| B. | 导管B连接病人吸氧气的塑胶管 | |
| C. | 该装置可用来观察和调节输出氧气的速度 | |
| D. | 该装置可让病人吸入湿润的氧气 |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42- | |
| B. | 加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+ | |
| C. | 使红色石蕊试纸变蓝色的溶液:Na+、ClO-、Cl-、S2- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液:Fe2+、Cl-、MnO4-、SO42- |
5.只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、淀粉溶液,这种试剂是( )
| A. | 饱和Na2CO3溶液 | B. | Cu(OH)2悬浊液 | C. | 烧碱溶液 | D. | 碘水 |
19.下列说法正确的是( )
| A. | C11H24、C27H56、C29H60三种物质互为同系物 | |
| B. | C33H68在常温下为液态 | |
| C. | C35H72中氢原子被氯气取代,最多需氯气35mol | |
| D. | 正二十一烷分子中所有碳原子在一条直线上 |
15.下列装置所示的实验能达到实验目的是( )
| A. | 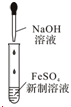 制备Fe(OH)2并观察颜色 | B. | 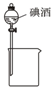 分离碘酒中的碘和酒精 | ||
| C. | 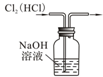 除去Cl2中的HCl | D. |  定容 |
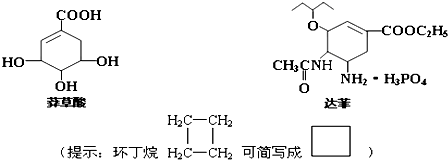
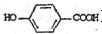 ),请写出此化学方程式(有机物用结构简式表示)
),请写出此化学方程式(有机物用结构简式表示)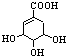 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$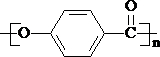 ;
;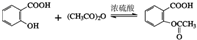 +CH3COOH;
+CH3COOH;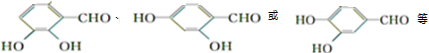 .
.