题目内容
8.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1mol乙基(-C2H5)中含有的电子数为16NA | |
| B. | 8g CH4中含有10NA个电子 | |
| C. | 标准状况下22.4L氯仿(三氯甲烷)中共价键数目为4NA | |
| D. | 28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA |
分析 A、乙基不带电荷;
B、求出甲烷的物质的量,然后根据甲烷为10电子分子来分析;
C、标况下氯仿为液态;
D、乙烯、丙烯和丁烯的最简式均为CH2.
解答 解:A、乙基不带电荷,故1mol乙基中含17mol电子即17NA个,故A错误;
B、8g甲烷的物质的量为0.5mol,而甲烷为10电子分子,故0.5mol甲烷中含5mol电子即5NA个,故B错误;
C、标况下氯仿为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、乙烯、丙烯和丁烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量为n=$\frac{28g}{14g/mol}$=2mol,则含有的碳原子为2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列离子反应方程式书写正确的是( )
| A. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| B. | 氨气通入醋酸溶液中:NH3+H+═NH4+ | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3H+ | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
19.亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄人过量的铁也有害.下面是一种常见补铁药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸;与Vc(维生素C)同服可增加本品吸收.
(一)甲同学设计了以下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
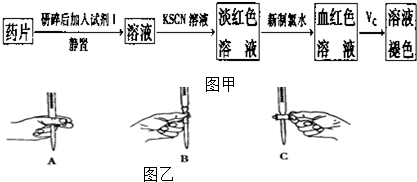
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为5Fe2++8H++MnO-4═5Fe3++Mn2++4H2O.准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用 0.020mol/L的KMnO4溶液滴定,用去KMnO4溶液记录如下:
(1)乙同学在计算时取用KMnO4的体积数据为12.0mL;
(2)该药品含“铁”的含量是33.6%(填数值,不需计算过程)
(3)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是C(填编号)
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(4)本实验滴定过程中滴定管需用高锰酸钾标准溶液润洗,其操作方法是在酸式滴定管中加入1-2mLKMnO4溶液,将滴定管横过来并转动,让KMnO4溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次.
操作滴定管的图示正确的是A(填编号)
(5)某同学做用标准NaOH溶液滴定HCl溶液测定其浓度,下列不当操作会导致实验结果偏高的是df
a.酸式滴定管在装酸液前未用待测盐酸溶液润洗.
b.开始实验时碱式滴定管尖嘴部分没有气泡,滴定结束生成气泡
c.锥形瓶内溶液颜色变化由无色变为粉红色,立即记下滴定管液面所在刻度.
d.盛待测溶液的锥形瓶滴定前用待测液液润洗.
e.锥形瓶在装盐酸后,又加了少量蒸馏水后滴定.
f.若用含少量NaCl的NaOH固体配制标准溶液用来滴定上述盐酸.
(一)甲同学设计了以下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:

(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为5Fe2++8H++MnO-4═5Fe3++Mn2++4H2O.准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用 0.020mol/L的KMnO4溶液滴定,用去KMnO4溶液记录如下:
| 待测液 体积(mL) | 标准液 | |||||
| 浓度(mol/L) | 滴定前 | 滴定后 | 体积(mL) | 平均值(mL) | ||
| 第一次 | 20.00 | 0.0200 | 0.00 | 14.30 | ||
| 第二次 | 0.20 | 12.22 | ||||
| 第三次 | 0.00 | 11.98 | ||||
(2)该药品含“铁”的含量是33.6%(填数值,不需计算过程)
(3)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是C(填编号)
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(4)本实验滴定过程中滴定管需用高锰酸钾标准溶液润洗,其操作方法是在酸式滴定管中加入1-2mLKMnO4溶液,将滴定管横过来并转动,让KMnO4溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次.
操作滴定管的图示正确的是A(填编号)
(5)某同学做用标准NaOH溶液滴定HCl溶液测定其浓度,下列不当操作会导致实验结果偏高的是df
a.酸式滴定管在装酸液前未用待测盐酸溶液润洗.
b.开始实验时碱式滴定管尖嘴部分没有气泡,滴定结束生成气泡
c.锥形瓶内溶液颜色变化由无色变为粉红色,立即记下滴定管液面所在刻度.
d.盛待测溶液的锥形瓶滴定前用待测液液润洗.
e.锥形瓶在装盐酸后,又加了少量蒸馏水后滴定.
f.若用含少量NaCl的NaOH固体配制标准溶液用来滴定上述盐酸.
16.化学与生活、生产密切相关,下列说法正确的是( )
| A. | 煤的气化和液化都是化学变化 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 铁、铝、铜在空气中长期放置表面都会生成氧化物 | |
| D. | 二氧化硫可广泛用于食品的增白 |
3.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用.下列化学反应,不符合绿色化学概念的是( )
| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 制CuSO4:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CuO+H2SO4(稀)═CuSO4+H2O |
13.下列有关叙述正确的是( )
| A. | 在Cl2中点燃铁丝,有FeCl2生成 | |
| B. | 实验室利用废铜屑制取CuSO4溶液的最好的方法是将铜屑在空气中灼烧后再溶于稀H2SO4 | |
| C. | 小苏打的主要成分是碳酸钠 | |
| D. | 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气 |
20.下列说法正确的是( )
| A. | 常温下物质的量浓度相等的①(NH4)2CO3溶液、②(NH4)2SO4溶液和③NH4Cl溶液中,水的电离程度:①>③>② | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)=c(Cl-) | |
| C. | 某溶液中水电离出的c(H+)=1.0×10-12mol/L,则此溶液中K+、HCO3-、Cl-、SO32-可以大量共存 | |
| D. | 0.1mol氯气与足量氢氧化钠溶液(常温)反应,转移电子0.1NA |
18.下列各组离子能大量共存的是( )
| A. | K+、Fe3+、SCN-、Cl- | B. | Fe3+、K+、OH-、SO42- | ||
| C. | Fe2+、K+、Cl-、SO42- | D. | Na+、H+、SO42-、CO32- |
 (1)其中的铁、钙是指③(填序号);①分子 ②原子 ③元素
(1)其中的铁、钙是指③(填序号);①分子 ②原子 ③元素