题目内容
3.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用.下列化学反应,不符合绿色化学概念的是( )| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 制CuSO4:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CuO+H2SO4(稀)═CuSO4+H2O |
分析 A.消除SO2气体,方法合理科学,避免空气污染,符合绿色环保要求;
B.消除制硝酸工业尾气氮的氧化物污染,避免酸雨的形成,符合绿色环保要求;
C.由此法制取硫酸铜,代价太大,且生成SO2气体有毒,不符合倡导的绿色化学;
D.由此法制取硫酸铜,无污染性气体生成,符合倡导的绿色化学.
解答 解:A.既消除硫酸厂尾气排放的SO2气体,还能得到(NH4)2SO3这种氮肥,不但方法合理科学,而且避免空气污染,符合绿色环保要求,故A不选;
B.用此法消除制硝酸工业尾气氮的氧化物污染,防止空气污染,避免酸雨的形成,符合绿色环保要求,故B不选;
C.由此法制取硫酸铜,代价太大,且生成SO2气体,既不经济又得产生有毒气体污染空气,不符合倡导的绿色化学,故C选;
D.由此法制取硫酸铜,无污染性气体生成,符合倡导的绿色化学,故D不选;
故选C.
点评 本题考查了“绿色化学”的含义,解答本题的关键是要读懂题目要求,准确理解绿色化学的含义,题目难度不大.

练习册系列答案
相关题目
13.下列关于如图所示实验的说法正确的是( )
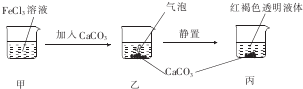

| A. | 甲、丙两液体均可产生丁达尔现象 | |
| B. | 乙中产生的气泡能使BaCl2溶液变浑浊 | |
| C. | 若忽略溶液体积的变化,则烧杯中c(Cl-)不变 | |
| D. | 若将CaC03换成CaS04,也可得到相同的实验现象 |
14.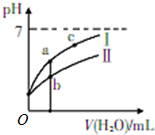 已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.
已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.
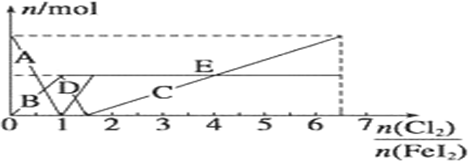
(1)图象中,曲线Ⅰ表示的酸是CH3COOH(填化学式);
(2)a、b、c三点中,水的电离程度由大到小的顺序是c>a>b(用编号表示).
(3)25℃时,NaClO溶液的水解平衡常数Kh=3.3×10-7molL-1.
(4)25℃时,NaHCO3溶液存在水解平衡,写出其水解的离子方程式HCO3-+H2O≒H2CO3+OH-
(5)0.1mol/L Na2CO3溶液中c(OH)-c(H+)=c(HCO3-)+2c(H2CO3).(用含c(HCO${\;}_{3}^{-}$),c(H2CO3)的关系式表示).
 已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.
已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.| CH2COOH | HClO | H2CO2 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
(2)a、b、c三点中,水的电离程度由大到小的顺序是c>a>b(用编号表示).
(3)25℃时,NaClO溶液的水解平衡常数Kh=3.3×10-7molL-1.
(4)25℃时,NaHCO3溶液存在水解平衡,写出其水解的离子方程式HCO3-+H2O≒H2CO3+OH-
(5)0.1mol/L Na2CO3溶液中c(OH)-c(H+)=c(HCO3-)+2c(H2CO3).(用含c(HCO${\;}_{3}^{-}$),c(H2CO3)的关系式表示).
18.某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )
| A. | 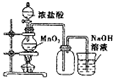 如果MnO2过量,浓盐酸就可全部消耗 | |
| B. | 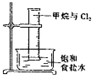 量筒中发生了取代反应 | |
| C. | 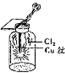 生成蓝色的烟 | |
| D. |  干燥的有色布条褪色,说明氯气有漂白性 |
8.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol乙基(-C2H5)中含有的电子数为16NA | |
| B. | 8g CH4中含有10NA个电子 | |
| C. | 标准状况下22.4L氯仿(三氯甲烷)中共价键数目为4NA | |
| D. | 28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA |
15.下列叙述正确的是( )
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 浓H2SO4不稳定,光照易分解 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |