题目内容
20.下列说法正确的是( )| A. | 常温下物质的量浓度相等的①(NH4)2CO3溶液、②(NH4)2SO4溶液和③NH4Cl溶液中,水的电离程度:①>③>② | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)=c(Cl-) | |
| C. | 某溶液中水电离出的c(H+)=1.0×10-12mol/L,则此溶液中K+、HCO3-、Cl-、SO32-可以大量共存 | |
| D. | 0.1mol氯气与足量氢氧化钠溶液(常温)反应,转移电子0.1NA |
分析 A.铵根离子水解程度是微弱的,则氯化铵溶液中铵根离子浓度最小;碳酸根离子促进了铵根离子的水解,则①中铵根离子浓度小于②;
B.溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(Cl-)+c(CH3COO-);
C.水电离出的c(H+)=1.0×10-12mol/L,该溶液为酸性或碱性溶液,碳酸氢根离子、亚硫酸根离子与氢离子反应;亚硫酸氢根离子与氢氧根离子反应;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂.
解答 解:A.相同物质的量浓度的(NH4)2SO4与(NH4)2CO3所含c(NH4+)比NH4Cl溶液中,(NH4)2CO3溶液中碳酸根离子促进铵根离子的水解,(NH4)2SO4溶液中硫酸根离子对铵根离子水解无影响,所以溶液中c(NH+4)大小为:(NH4)2SO4>(NH4)2CO3>NH4Cl,即:②>①>③,故A错误;
B.常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则满足:c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(Cl-)+c(CH3COO-),所以混合溶液中:c(Na+)>c(Cl-),故B错误;
C.水电离出的c(H+)=1.0×10-12mol/L,该溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故C错误;
D.0.1mol氯气与足量氢氧化钠溶液(常温)反应生成0.1mol氯化钠和0.1mol次氯酸钠,反应转移了0.1mol导致,转移电子数为0.1NA,故D正确;
故选D.
点评 本题考查了离子浓度大小比较、氧化还原反应的计算、盐的水解原理、离子共存等知识,题目难度中等,试题考查较综合,注意明确盐的水解原理、氧化还原反应中电子转移的计算方法,熟练掌握判断离子浓度大小的常用方法.

| A. | 1mol乙基(-C2H5)中含有的电子数为16NA | |
| B. | 8g CH4中含有10NA个电子 | |
| C. | 标准状况下22.4L氯仿(三氯甲烷)中共价键数目为4NA | |
| D. | 28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA |
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 浓H2SO4不稳定,光照易分解 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
| A. | $\frac{Vn}{22.4}$ | B. | $\frac{22.4n}{V}$ | C. | $\frac{5.6n}{V}$ | D. | $\frac{Vn}{5.6}$ |
| A. | 2:1 | B. | 2:3 | C. | 1:1 | D. | 1:2 |
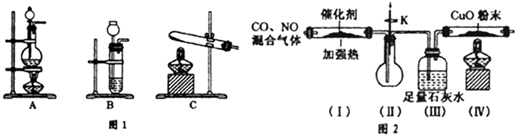
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.