题目内容
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
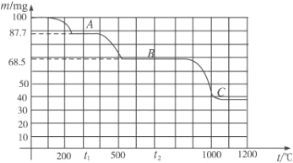
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

①反应的热化学方程式为:_______________________________________。
②已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131 kJ·mol-1,则C(s)+CO2(g)=2CO(g)ΔH=________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g)ΔH=___________________。
【答案】(1)①CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41 kJ·mol-1
②+172 kJ·mol-1 (2)-46.2 kJ·mol-1
【解析】
试题分析:(1)①根据图像可知反应热=-41kJ/mol,所以反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol;
②已知:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)△H=+131 kJ/mol
则根据盖斯定律可知后者减去前者即得到C(s)+CO2(g)=2CO(g)△H=+172 kJ/mol;
(2)反应热=反应物中键能之和-生成物中键能之和,则1/2N2(g)+3/2H2(g)===NH3(g)△H=0.5×948.9kJ/mol+1.5×436.0 kJ/mol-3×391.55 kJ/mol=-46.2 kJ/mol。