题目内容
【题目】应对雾霾污染、改善空气质量需要从多方面入手。
I.研究发现,NOx是雾霾的主要成分之一,NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50kJ·mol-1
2NO(g) △H=+180.50kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=-566.00 kJ·mol-1
2CO2(g) △H=-566.00 kJ·mol-1
为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环,写出该反应的热化学方程式 。
II.开发利用清洁能源可减少污染,解决雾霾问题。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景,一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。
CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。

(1)该反应的反应热△H 0(填“>”或“<”),压强的相对大小与P1 P2(填“>”或“<”)。
(2)该反应化学平衡常数表达式为 。
(3)下列各项中,不能说明该反应已经达到平衡的是 。
A.容器内气体压强不再变化
B.v(CO):v(H2):v(CH3OH)=1:2:1
C.容器内的密度不再变化
D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下,在保证H2浓度不变的情况下,增大容器的体积,平衡 (填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的依据是 。
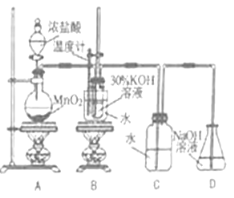
III.依据燃烧反应原理,合成的甲醇可以设计如图所示的燃料电池装置。

(1)负极电极反应式为 。
(2)电池工作时,若电流强度为I,1个电子所带电量为q,NA为阿伏伽德罗常数的值,则该装置每分钟消耗甲醇的物质的量为 mol(假设化学能全部转化为电能)。
【答案】Ⅰ.2CO(g) +2NO(g) ![]() N2(g)+2CO2(g) △H=-746.50kJ·mol-1 ;
N2(g)+2CO2(g) △H=-746.50kJ·mol-1 ;
Ⅱ.(1)<;>;(2)K=![]() ;(3)BC;(4)C,保证C(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商Qc=
;(3)BC;(4)C,保证C(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商Qc=![]() ,推得Qc=K,所以平衡不移动;Ⅲ.(1)CH3OH-6e—+8OH—=CO32—+6H2O;(2)
,推得Qc=K,所以平衡不移动;Ⅲ.(1)CH3OH-6e—+8OH—=CO32—+6H2O;(2)![]() 。
。
【解析】
试题分析:I.转化成无毒物质.2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),①N2(g)+O2(g)
2CO2(g)+N2(g),①N2(g)+O2(g) ![]() 2NO(g),②2CO(g)+O2
2NO(g),②2CO(g)+O2![]() 2CO2(g),②-①,得出NO(g)+CO(g)
2CO2(g),②-①,得出NO(g)+CO(g) ![]() CO2(g)+N2(g) △H=(-566-180.5)kJ·mol-1=-746.50kJ·mol-1;II.(1)随着温度升高,甲醇的体积分数减少,根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,即正反应方向为△H<0,作等温线,随着压强增大,平衡向体积减小的方向移动,根据图表,即p1>p2;(2)根据化学平衡常数定义,K=c(CH3OH)/[c(CO)×c2(H2)];(3)A、反应前后气体系数之和不相等,则压强不变,说明反应达到平衡,故错误;B、没有指明反应的方向,不能说明是否达到平衡,故正确;C、根据密度的定义,恒容说明体积不变,组分都是气体,质量不变,密度不变,不能说明反应达到平衡,故错误;D、根据平均摩尔质量的定义,气体质量不变,反应前后气体系数之和不等,气体物质的量减少,因此平均摩尔质量不变,说明达到平衡,故错误;E、根据化学平衡状态的定义,当组分的质量分数不变,说明反应达到平衡,故错误;(4) 保证C(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商Qc=
CO2(g)+N2(g) △H=(-566-180.5)kJ·mol-1=-746.50kJ·mol-1;II.(1)随着温度升高,甲醇的体积分数减少,根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,即正反应方向为△H<0,作等温线,随着压强增大,平衡向体积减小的方向移动,根据图表,即p1>p2;(2)根据化学平衡常数定义,K=c(CH3OH)/[c(CO)×c2(H2)];(3)A、反应前后气体系数之和不相等,则压强不变,说明反应达到平衡,故错误;B、没有指明反应的方向,不能说明是否达到平衡,故正确;C、根据密度的定义,恒容说明体积不变,组分都是气体,质量不变,密度不变,不能说明反应达到平衡,故错误;D、根据平均摩尔质量的定义,气体质量不变,反应前后气体系数之和不等,气体物质的量减少,因此平均摩尔质量不变,说明达到平衡,故错误;E、根据化学平衡状态的定义,当组分的质量分数不变,说明反应达到平衡,故错误;(4) 保证C(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商Qc= ![]() ,推得Qc=K,所以平衡不移动,故选项C正确;III.(1)通氧气的一极为正极,通甲醇一极为负极,,此装置为燃料电池,CH3OH+2O2→CO2+2H2O,电解质溶液为KOH,CO2转变成CO32-,因此负极电极反应式:CH3OH+8OH--6e-=CO32-+6H2O;(2)转移电子的物质的量为60I/qNAmol,根据电极反应式,推出n(CH3OH)=1OI/qNAmol。
,推得Qc=K,所以平衡不移动,故选项C正确;III.(1)通氧气的一极为正极,通甲醇一极为负极,,此装置为燃料电池,CH3OH+2O2→CO2+2H2O,电解质溶液为KOH,CO2转变成CO32-,因此负极电极反应式:CH3OH+8OH--6e-=CO32-+6H2O;(2)转移电子的物质的量为60I/qNAmol,根据电极反应式,推出n(CH3OH)=1OI/qNAmol。

【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+ = Cu + Cu2+ + H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是 。
(2)反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)请写出生成该离子的离子方程式 。
(3)x、y对应的数值范围分别是 、 。
(4)电解法获取Cu时,阴极反应式为 ,阳极反应式为 。
(5)下列关于NaClO调pH的说法正确的是 。
a. 加入NaClO可使溶液的pH降低
b. NaClO能调节pH的主要原因是由于发生反应ClO-+ H+![]() HClO, ClO-消耗H+,从而达到调节pH的目的
HClO, ClO-消耗H+,从而达到调节pH的目的
c .NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O![]() HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为_________________________ 。