题目内容
【题目】一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体。
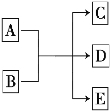
(1)若A、C、D均含氯元素,C为氯碱工业的原料,D溶液具有漂白性,则A与B反应的化学方程式_____________________;D溶液可使淀粉KI溶液显蓝色,则D与KI在溶液中反应的离子方程式是 ;检验C中所含阴离子的实验方法是_____________________。
(2)若A为红色金属,B为某酸的浓溶液,D为可形成酸雨的无色气体。A与B反应的化学方程式是_______________。amol A与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是_____________________。
【答案】(1)Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-;取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-
(2)Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;amol≤n(NaOH)≤2amol
CuSO4+SO2↑+2H2O;amol≤n(NaOH)≤2amol
【解析】
试题分析:常温下无色液体一般为H2O。
(1)A是单质且含氯元素,A为Cl2,C为氯碱工业的原料,应是NaCl,根据框图分析D应是NaClO,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O。NaClO具有强氧化性,可将I-氧化生成I2,离子方程式为ClO-+2I-+H2O=I2+Cl-+2OH-。物质C中含有Cl-,其检验方法为取适量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明含有Cl-,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-;取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-;
(2)A为红色金属,推知A为Cu,D为可形成酸雨的无色气体,应为SO2,则B为浓硫酸,反应方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。amol的Cu与足量浓硫酸反应生成amol SO2,SO2与NaOH反应的产物可能是Na2SO3、NaHSO3,也可能是Na2SO3与NaHSO3的混合物,故所需NaOH的物质的量的范围是amol≤n(NaOH)≤2amol,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O。amol的Cu与足量浓硫酸反应生成amol SO2,SO2与NaOH反应的产物可能是Na2SO3、NaHSO3,也可能是Na2SO3与NaHSO3的混合物,故所需NaOH的物质的量的范围是amol≤n(NaOH)≤2amol,故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;amol≤n(NaOH)≤2amol。
CuSO4+SO2↑+2H2O;amol≤n(NaOH)≤2amol。

