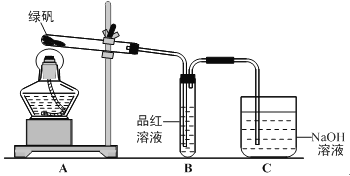
题目内容
【题目】![]() 气体通入滴有酚酞的NaOH溶液,红色逐渐褪去,可能的原因:
气体通入滴有酚酞的NaOH溶液,红色逐渐褪去,可能的原因:
(1)_________
(2)_________
(3)简述设计实验证明:_________。
【答案】假设一:![]() 或
或![]() 与水作用的产物漂白了红色的溶液 假设二:
与水作用的产物漂白了红色的溶液 假设二:![]() 与NaOH反应降低了溶液的pH 方案一:取上述褪色后的溶液于试管,加入NaOH溶液,溶液恢复红色,则假设二成立;
与NaOH反应降低了溶液的pH 方案一:取上述褪色后的溶液于试管,加入NaOH溶液,溶液恢复红色,则假设二成立;
方案二:取上述褪色后的溶液于试管,用酒精灯加热,溶液恢复红色,,则假设一成立
【解析】
SO2气体通入滴有酚酞的NaOH溶液,红色逐渐褪去,可能的原因:
![]() 或
或![]() 与水作用的产物漂白了红色的溶液;
与水作用的产物漂白了红色的溶液;![]() 与NaOH反应降低了溶液的pH;
与NaOH反应降低了溶液的pH;
设计实验证明的方法:方案一:取上述褪色后的溶液于试管,加入NaOH溶液,溶液恢复红色,则假设二成立;
方案二:取上述褪色后的溶液于试管,用酒精灯加热,溶液恢复红色,则假设一成立,
(1)故答案为:假设一:![]() 或
或![]() 与水作用的产物漂白了红色的溶液;
与水作用的产物漂白了红色的溶液;
(2)假设二:![]() 与NaOH反应降低了溶液的pH;
与NaOH反应降低了溶液的pH;
(3)方案一:取上述褪色后的溶液于试管,加入NaOH溶液,溶液恢复红色,则假设二成立;
方案二:取上述褪色后的溶液于试管,用酒精灯加热,溶液恢复红色,则假设一成立。

【题目】下列实验操作、现象与实验解释或结论正确的是![]()
![]()
编号 | 实验操作和现象 | 实验解释或结论 |
A | 向工业酒精中加入一小块钠,产生气泡 | 乙醇中含有羟基 |
B | 向锌和稀硫酸反应液中滴加几滴CuSO4溶液,速率加快 | CuSO4溶液起到了催化剂的作用 |
C | 将AlCl3熔化,没能检测到导电性 | AlCl3不是离子化合物 |
D | 将一定量的油脂加入到稀硫酸中,加入一段时间后静置,混合液仍分层 | 油脂在酸性条件下不能发生水解反应 |
A.AB.BC.CD.D
【题目】某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
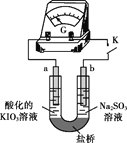
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
表盘 | |
| ||
时间/min | 0~t1 | t2~t3 | t4 | |
偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 | |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-