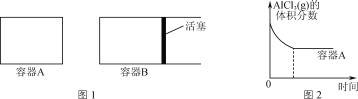
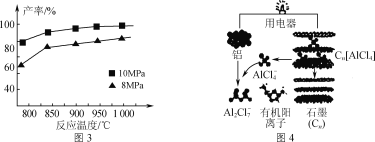
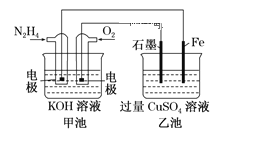
题目内容
【题目】为测定人体血液中Ca2+的含量,设计了如下方案:
![]()
有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4 K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗了0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为
A.0.001mol·L-1B.0.0025mol·L-1 C.0.0003mol·L-1D.0.0035mol·L-1
【答案】B
【解析】
由方程式Ca2++C2O42+=CaC2O4、CaC2O4+H2SO4=CaSO4↓+H2C2O4、2KMnO4+5H2C2O4+3H2SO4=H2SO4+2MnSO4+10CO2↑+8H2O可得关系式:5Ca2+~5CaC2O4~5H2C2O4~2KMnO4,令血液中含钙量为cmol/L,则:
5Ca2+~5CaC2O4~5H2C2O4~2KMnO4
5 2
cmol/L×0.015L 0.001molL-1×0.015L
所以cmol/L×0.015L×2=5×0.001molL-1×0.015L
解得c=0.0025molL-1;
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】(1)500℃时,在2L密闭容器内发生2SO2(g)+O2(g)![]() 2SO3(g)的反应,其中n(SO2)随时间的变化如下表:
2SO3(g)的反应,其中n(SO2)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①在第5s时,SO2的转化率为__________________。
②能说明该反应已达到平衡状态的是_________________。
a. v(SO2)=v(O2) b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(2)硅是信息技术的关键材料。
化学键 | H-H | Si-Cl | Si-Si | H-Cl |
E/kJ·mol-1 | 436.0 | 360 | 176 | 431.8 |
用H2还原气态SiCl4制得28g硅的反应热为__________________。
(3)目前,消除氮氧化物污染有多种方法。
用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式_______。
【题目】滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和 ![]() 如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×1017 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的
A.KIB.![]() C.KBrD.
C.KBrD.![]()