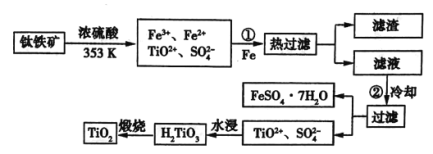
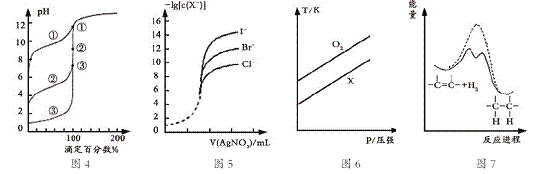
题目内容
【题目】硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图)。
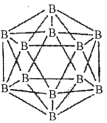
①在基态11B原子中,核外存在______对自旋相反的电子。
②若每个单元中有两个原子为l0B,其余为11B,则该单元结构的类型有______种。
(2)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由小到大的顺序为________,BH4-离子的空间构型是_____________,与BH4-互为等电子体的的分子有___________。
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_____、_______。与H3BO3酸性最接近的是__________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
(4)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞,B原子的杂化方式是___________。立方相氮化硼晶体的熔点要比磷化硼体高,其原因是_____________。

(5)己知磷化硼的晶胞参数a=478 pm,请列式计算该晶体的密度p=_____g.cm-3(用含NA的代数式表示即可,不需要计算出结果)。晶胞中硼原子和磷原子最近的核间距为_________pm。
【答案】 2 3 Na<B<H 四面体形 CH4 氢键 范德华力 A sp3 二者均为原子晶体,氮原子的半径小于磷原子, N-B 键的键长小于 P-B 键, N-B 键的键能大 ![]()
![]()
【解析】试题分析:(1)①同一个轨道中的电子自旋相反。
②根据两个l0B原子在晶胞中的相对位置分析,当选定1个顶点后,与它最近的顶点数为5个,然后就是5个,最远的是1个,即二取代物有3种。
(2) 根据NaBH4中H元素显负极、钠的活泼性大于B分析电负性,根据价电子理论分析BH4-离子的空间构型,等电子体是原子数相同、价电子数也相同的微粒。
(3)石墨中存在的作用力有共价键、分子间作用力,硼酸中含有O、H原子,所以存在氢键。B与Si的性质符合对角线原则。
(4)根据是磷化硼晶体的晶胞每个B原子与4个P原子成键,B原子的杂化方式是sp3 。立方相氮化硼晶体的熔点要比磷化硼体高,N原子的半径小于P,N-B键能大于B-P。
(5)己知磷化硼的晶胞参数a=478 pm,根据![]() 计算晶体的密度。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm
计算晶体的密度。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm![]()
![]() , 478 pm
, 478 pm![]()
![]() ,478 pm
,478 pm![]()
![]() )。478 pm
)。478 pm![]()
![]()
解析:(1)①同一个轨道中的电子自旋相反,B原子核外电子排布为1S22S22P1,核外存在2对自旋相反的电子。
②根据两个l0B原子在晶胞中的相对位置分析,当选定1个顶点后,与它最近的顶点数为5个,然后就是5个,最远的是1个,即二取代物有3种。
(2) 根据NaBH4中H元素显负极、钠的活泼性大于B,,所以电负性Na<B<H,根据价电子理论BH4-离子的价电子对数是![]() ,无孤对电子,所以空间构型为四面体形,等电子体是原子数相同、价电子数也相同的微粒,与BH4-互为等电子体的的分子有CH4。
,无孤对电子,所以空间构型为四面体形,等电子体是原子数相同、价电子数也相同的微粒,与BH4-互为等电子体的的分子有CH4。
(3)石墨中存在的作用力有共价键、分子间作用力,硼酸中含有O、H原子,所以存在氢键,硼酸晶体中存在的作用力有共价键、分子间作用力、氢键。B与Si的性质符合对角线原则,所以与H3BO3酸性最接近的是H4SiO4。
(4)根据是磷化硼晶体的晶胞每个B原子与4个P原子成键,B原子的杂化方式是sp3 。立方相氮化硼晶体的熔点要比磷化硼体高,N原子的半径小于P,N-B键能大于B-P,所以立方相氮化硼晶体的熔点要比磷化硼体高。
(5)根据均摊原则1个晶胞含有一个晶胞含有4个B,4个P,设有1mol晶胞,则体积为![]() ,质量为42
,质量为42![]() g,根据
g,根据![]() ,晶体的密度为
,晶体的密度为![]() =
=![]() 。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm
。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm![]()
![]() , 478 pm
, 478 pm![]()
![]() ,478 pm
,478 pm![]()
![]() ),所以晶胞中硼原子和磷原子最近的核间距为
),所以晶胞中硼原子和磷原子最近的核间距为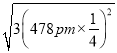 =
=![]() 。
。