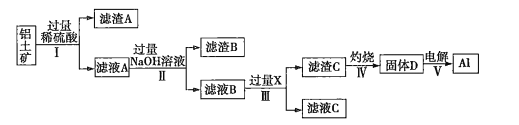
题目内容
【题目】钛(![]() )被称为继铁、铝之后的第三金属,钛白(
)被称为继铁、铝之后的第三金属,钛白(![]() )是目前使用最广泛的白色颜料。制备
)是目前使用最广泛的白色颜料。制备![]() 和
和![]() 的原料是钛铁矿,用含
的原料是钛铁矿,用含![]() 的钛铁矿(主要成分为
的钛铁矿(主要成分为![]() )制备
)制备![]() 的流程如下:
的流程如下:
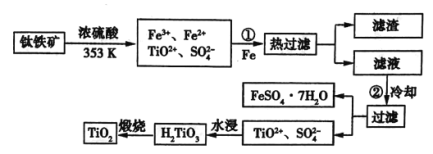
(1)步骤①加![]() 的目的是__________________;步骤②冷却的目的是_____________。
的目的是__________________;步骤②冷却的目的是_____________。
(2)考虑成本和废物的综合利用等因素,水浸后的废液中应加入______________处理。
(3)由金红石(![]() )制取单质钛(
)制取单质钛(![]() )的过程为
)的过程为![]() ,其中反应
,其中反应![]() 在氩气气氛中进行的理由是____________。
在氩气气氛中进行的理由是____________。
【答案】将![]() 还原为
还原为![]() 析出绿矾(
析出绿矾(![]() ) 碳酸钙(其它合理答案也可) 高温下镁和钛会与
) 碳酸钙(其它合理答案也可) 高温下镁和钛会与![]() 、
、![]() 反应,因此只能用稀有气体来保护
反应,因此只能用稀有气体来保护
【解析】
钛铁矿溶于浓硫酸,所有金属转变为自由离子,加入铁粉可以将![]() 还原为
还原为![]() ,此时热过滤除去过量的铁粉,再冷却使绿矾大量析出,过滤后可得绿矾,此时溶液中剩下的钛元素,经水浸后转变为偏钛酸
,此时热过滤除去过量的铁粉,再冷却使绿矾大量析出,过滤后可得绿矾,此时溶液中剩下的钛元素,经水浸后转变为偏钛酸![]() ,灼烧失水后即可得到钛白粉
,灼烧失水后即可得到钛白粉![]() 。
。
(1)分析题图可知,钛铁矿中的铁最终转化成副产品绿矾,所以要将+3价![]() 转化为+2价
转化为+2价![]() ;降低温度是为了减小
;降低温度是为了减小![]() 的溶解度,利于绿矾结晶析出;
的溶解度,利于绿矾结晶析出;
(2)水浸过程发生的离子反应为![]() ,废液呈酸性,可以考虑向水浸后的废液中加入
,废液呈酸性,可以考虑向水浸后的废液中加入![]() 等物质(合理即可);
等物质(合理即可);
(3)由于![]() 和
和![]() 易与空气中的
易与空气中的![]() 、
、![]() 等反应;故该反应要在氩气气氛中进行。
等反应;故该反应要在氩气气氛中进行。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】关于铝热反应的现象有如下描述:反应放出大量的热,并发出耀眼的光芒;纸漏斗的下部被烧穿,有熔融物落入沙中。已知![]() 、
、![]() 、
、![]() 、
、![]() 的熔点、沸点如表所示:
的熔点、沸点如表所示:
物质 |
|
|
|
|
熔点/℃ | 660 | 1565 | 2054 | 1535 |
沸点/℃ | 2467 | 3414 | 2980 | 2750 |
(1)某同学推测,铝热反应所得到的熔融物是铁铝合金,因为该反应放热能使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验,证明上述熔融物中含有金属铝,填写下列表格:
①所用试剂 | ______ |
②实验操作及现象 | ______ |
③有关反应的化学方程式 | ______ |
(3)欲在常温下溶解该熔融物,下列试剂中最好选用______(填序号),理由是_________________________。
a.浓硫酸 b.稀硫酸 c.硫酸锌溶液d. ![]() 溶液
溶液
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:![]() ?
?![]() 已知CO、
已知CO、![]() 、
、![]() 的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则
的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则![]() ______。
______。![]() 在一容积为2L的恒容密闭容器中加入
在一容积为2L的恒容密闭容器中加入![]() CO和
CO和![]()
![]() ,发生如下反应:CO
,发生如下反应:CO![]() ,实验测得
,实验测得![]() 和
和![]() 下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
时间 | 10min | 20min | 30min | 40min | 50min | 60min |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]() 由上述数据可以判断:
由上述数据可以判断:![]() ______
______![]()
![]() 时,
时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。![]() 该反应
该反应![]() 达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______
达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______![]() 选填编号
选填编号![]() 。
。
A 改用高效催化剂![]() 升高溫度
升高溫度![]() 缩小容器体积
缩小容器体积 ![]() 分离出甲醇
分离出甲醇 ![]() 增加CO的浓度
增加CO的浓度![]() 若保持
若保持![]() 不变,起始时加入CO、
不变,起始时加入CO、![]() 、
、![]() 的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。
的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。![]() 当反应在
当反应在![]() 达到20min时,控制体积不变,迅速将
达到20min时,控制体积不变,迅速将![]() ,
,![]() ,
,![]() 同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中
同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中![]() 浓度的变化趋势曲线:______
浓度的变化趋势曲线:______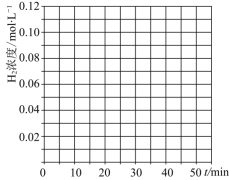
![]() 在以
在以![]() 为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。
为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。![]() 燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比
燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比![]()