题目内容
【题目】某学习小组利用图1装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3 . 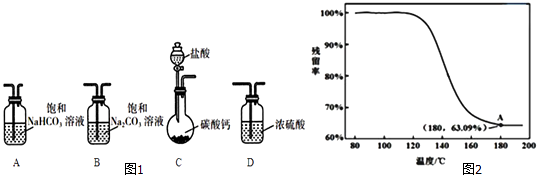
(1)选取必要的实验装置,正确的连接顺序为(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3 , 小组同学提出下列实验方案:甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 | 0.2molL﹣1 | 0.1molL﹣1 | 0.02molL﹣1 |
0.2molL﹣1 | 浑浊 | 浑浊 | 少许浑浊 |
0.1molL﹣1 | 浑浊 | 少许浑浊 | 无现象 |
0.02molL﹣1 | 少许浑浊 | 无现象 | 无现象 |
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[己知:0.l molL﹣1 NaHCO3溶液电离出的c(CO32﹣)为0.001lmolL﹣1 , Ksp(BaCO3)=5.1×10﹣9]
答: .
(ii)产生浑浊(伴有气体产生)的离子方程式 .
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:
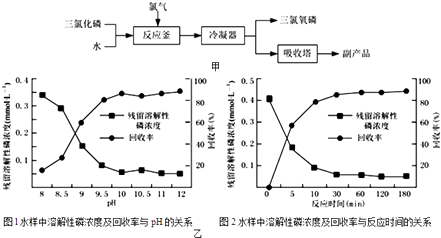
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是 .
(残留率= ![]() ×100%)
×100%)
【答案】
(1)CAB
(2)不可行;Qc=c(Ba2+)×c(CO32﹣)= ![]() ×0.0011=1.1×10﹣4>5.1×10﹣9;Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O;另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH;制得的固体样品是纯净的NaHCO3
×0.0011=1.1×10﹣4>5.1×10﹣9;Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O;另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH;制得的固体样品是纯净的NaHCO3
【解析】解:(1)C为发生装置,盐酸与碳酸钙反应生成二氧化碳气体和氯化钙,其中盐酸易挥发,故应先选取碳酸氢钠除去混合气体中的HCl,故仪器连接顺序为:CAB,所以答案是:CAB;(2)①饱和澄清石灰水与碳酸钠和碳酸氢钠均能反应生成碳酸钙沉淀,故甲方案不可行,所以答案是:不可行;②(i)两种溶液等体积混合后,溶液中钡离子浓度= ![]() =0.1mol/L,0.1 molL﹣1 NaHC03溶液电离出的c(CO32﹣)为0.0011 molL﹣1 , 故Q=c(Ba2+)×c(CO32﹣)=
=0.1mol/L,0.1 molL﹣1 NaHC03溶液电离出的c(CO32﹣)为0.0011 molL﹣1 , 故Q=c(Ba2+)×c(CO32﹣)= ![]() ×0.0011=1.1×10﹣4>5.1×10﹣9 , 故会产生沉淀,
×0.0011=1.1×10﹣4>5.1×10﹣9 , 故会产生沉淀,
所以答案是:Qc=c(Ba2+)×c(CO32﹣)= ![]() ×0.0011=1.1×10﹣4>5.1×10﹣9;(ii)钡离子与碳酸氢钠电离出的碳酸根结合生成碳酸钡沉淀,从而促进了碳酸氢根的电离,使其向生成碳酸根和氢离子的方向移动,故离子反应方程式为:Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O,
×0.0011=1.1×10﹣4>5.1×10﹣9;(ii)钡离子与碳酸氢钠电离出的碳酸根结合生成碳酸钡沉淀,从而促进了碳酸氢根的电离,使其向生成碳酸根和氢离子的方向移动,故离子反应方程式为:Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O,
所以答案是:Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O;
③丙方案为测定pH法,由于碳酸氢钠属于强碱弱酸盐,溶于水中配成V mL的溶液,利用准确度较高的pH计进行样品的pH值,然后测量等质量等浓度的分析纯NaHC03的pH值,最后比较即可,
所以答案是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH;
④发生反应为2NaHCO3 ![]() Na2CO3+H2O+CO2↑,由图中所给数据可知在180℃时,固体的残留率为63.09%,
Na2CO3+H2O+CO2↑,由图中所给数据可知在180℃时,固体的残留率为63.09%,
设碳酸氢钠为100g,
则2NaHCO3 ![]() Na2CO3+H2O+CO2↑,
Na2CO3+H2O+CO2↑,
168 106
100g xg
解得x=63.09g,
即理论上碳酸氢钠每有100g分解应生成63.09g固体,
故由图可知100g样品分解恰好生成固体为63.09g,故此样品只含有为NaHCO3 ,
所以答案是:制得的固体样品是纯净的NaHCO3 .

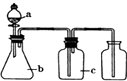
【题目】下表中a、b、c表示相应仪器中加人的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
A.A
B.B
C.C
D.D