题目内容
已知反应FeO(s)+CO(g) = Fe(s)+CO2(g) 的平衡常数K=0.5(1273K)。若起始浓度c(CO)= 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加的FeO量会不会促使平衡向正方向移动?
解:(1) 浓度商Q=![]() =0.2
=0.2
Q<K,反应将向右进行,
(2) 设平衡时CO2增加的浓度为x mol·L-1,则平衡时:
FeO(s) + CO(g) =Fe(s)+CO2(g)
(mol·L-1) 0.05-x 0.01+x
K=![]() =0.5
=0.5
解之,x=0.01 mol·L-1
[CO]= 0.05 mol·L-1-0.01 mol·L-1=0.04 mol·L-1
[CO2]=0.01 mol·L-1+0.01 mol·L-1=0.02 mol·L-1
![]()
(3)增加的FeO量不会促使平衡向正方向移动。
答:CO和CO2的平衡浓度分别为0.04 mol·L-1 、0.02 mol·L-1;CO的转化率为20% 。增加的FeO量不会促使平衡向正方向移动。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO) = 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答:
Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO) = 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答: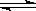 Fe(s)+CO2(g)
的Kc=0.5(1273K)。若起始浓度c(CO) = 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答:
Fe(s)+CO2(g)
的Kc=0.5(1273K)。若起始浓度c(CO) = 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答: