题目内容
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g) 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A.以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是A.以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
A D
试题分析:依据化学平衡三段式列式计算
2A(g)+B(g)═2C(g)
起始量(mol) 1 1 0
变化量(mol)0.6 0.3 0.6
平衡量(mol)0.4 0.7 0.6
A、以A浓度变化表示的反应速率=
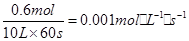 ;故A正确;B、其他条件不变,将容器体积变为5L,C的浓度变为原来的2倍,但反应前后气体体积变化,缩小体积压强增大,平衡正向进行,C的平衡浓度变大于原来的2倍,故B错误;C、其他条件不变,若增大压强,平衡正向进行,则物质A的转化率增大,故C错误;D、达到平衡时,C的体积百分含量=
;故A正确;B、其他条件不变,将容器体积变为5L,C的浓度变为原来的2倍,但反应前后气体体积变化,缩小体积压强增大,平衡正向进行,C的平衡浓度变大于原来的2倍,故B错误;C、其他条件不变,若增大压强,平衡正向进行,则物质A的转化率增大,故C错误;D、达到平衡时,C的体积百分含量=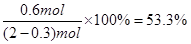 故D正确;故选AD.
故D正确;故选AD.
练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
 CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2): Ni(CO)4(g) ΔH < 0
Ni(CO)4(g) ΔH < 0 Ni(纯,s)+4CO(g) ΔH > 0
Ni(纯,s)+4CO(g) ΔH > 0 FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g) 
 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。 min
min FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1) 2C(g),下表为反应在不同压强和温度下物质A的平衡转化率,有关说法正确的是( )
2C(g),下表为反应在不同压强和温度下物质A的平衡转化率,有关说法正确的是( ) A转化率 压强
A转化率 压强 PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表: C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )