题目内容
I.高炉炼铁的主要反应为Fe2O3+3CO2Fe+3CO2。
已知该反应的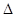 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
(1)该时间范围内的平均反应速率v(CO2)=_________mol/L min
min
(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
E.使用合适的催化剂 F.减少容器的容积
Ⅱ.已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
(4)通过表格中的数值可以推断:反应①的△H_ O。(填“>”“<”)
(5)现有反应③:该反应的平衡常数的数学表
达式K3=____。
(6)根据反应①和②可以推导出Ki,Kz和玛之间的关系式。K3=__________。据此关系式和上表数据,也能推断出反应③的△H_ _0(填“>”“<”)。
已知该反应的
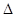 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。(1)该时间范围内的平均反应速率v(CO2)=_________mol/L
 min
min(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
| A.减少Fe的量 | B.增加Fe2O3的量 |
| C.升高反应温度 | D.移出部分CO2 |
Ⅱ.已知化学反应①:Fe(s)+CO2(g)
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(4)通过表格中的数值可以推断:反应①的△H_ O。(填“>”“<”)
(5)现有反应③:该反应的平衡常数的数学表
达式K3=____。
(6)根据反应①和②可以推导出Ki,Kz和玛之间的关系式。K3=__________。据此关系式和上表数据,也能推断出反应③的△H_ _0(填“>”“<”)。
(14分)
(1)0.006 (2分)
(2)60% (2分)
(3)D (2分)
(4)> (2分)
(5)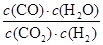 (2分)
(2分)
(6)K3=K1/K2 (2分) > (2分)
(1)0.006 (2分)
(2)60% (2分)
(3)D (2分)
(4)> (2分)
(5)
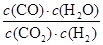 (2分)
(2分)(6)K3=K1/K2 (2分) > (2分)
I.⑴在1000℃时,该反应的平衡常数K=64,在10L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K= =
= =64,计算得到x=0.6
=64,计算得到x=0.6
转化率=60%
v(CO2)=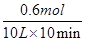 =0.006mol/L
=0.006mol/L min
min
故答案为:⑴0.006mol/L min⑵60%;
min⑵60%;
⑶A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故C错误;
D.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故D正确;
E.加入合适的催化剂,平衡不移动,故E错误;
F.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故F错误;
故选D;
⑷由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热,△H >0
故答案为:>;
⑸依据反应CO2(g)+H2(g) CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=
CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=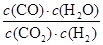
,故答案为: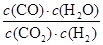
(6)已知:①Fe(s)+CO2(g) FeO(s)+CO(g);
FeO(s)+CO(g);
②Fe(s)+H2O(g) FeO(s)+H2(g);
FeO(s)+H2(g);
利用盖斯定律将①-②可得:③H2(g)+CO2(g) CO(g)+H2O(g);
CO(g)+H2O(g);
则K3=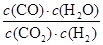 =
=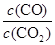 ÷
÷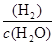 =
=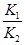 ;
;
依据图表平衡常数数据分析,温度升高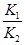 增大,说明平衡正向进行,反应是吸热反应;△H>0,
增大,说明平衡正向进行,反应是吸热反应;△H>0,
答案: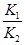 ,>。
,>。
Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=
 =
= =64,计算得到x=0.6
=64,计算得到x=0.6转化率=60%
v(CO2)=
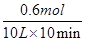 =0.006mol/L
=0.006mol/L min
min故答案为:⑴0.006mol/L
 min⑵60%;
min⑵60%;⑶A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故C错误;
D.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故D正确;
E.加入合适的催化剂,平衡不移动,故E错误;
F.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故F错误;
故选D;
⑷由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热,△H >0
故答案为:>;
⑸依据反应CO2(g)+H2(g)
 CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=
CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=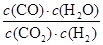
,故答案为:
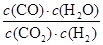
(6)已知:①Fe(s)+CO2(g)
 FeO(s)+CO(g);
FeO(s)+CO(g);②Fe(s)+H2O(g)
 FeO(s)+H2(g);
FeO(s)+H2(g);利用盖斯定律将①-②可得:③H2(g)+CO2(g)
 CO(g)+H2O(g);
CO(g)+H2O(g);则K3=
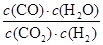 =
=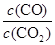 ÷
÷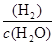 =
=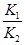 ;
;依据图表平衡常数数据分析,温度升高
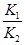 增大,说明平衡正向进行,反应是吸热反应;△H>0,
增大,说明平衡正向进行,反应是吸热反应;△H>0,答案:
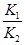 ,>。
,>。
练习册系列答案
相关题目
 4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0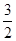 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化 Z(g) △H<0分两步进行:
Z(g) △H<0分两步进行: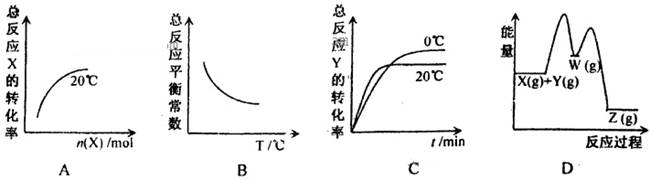
 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是 C(g)+D(g)的化学平衡常数和温度的关系如下:
C(g)+D(g)的化学平衡常数和温度的关系如下: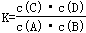
 Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
 x C(g) + 2D(g),容器里的压强逐渐降低,经5s后保持不变。在此5s内C的平均反应速率为0.1 mol·L-1·s-1。则下列的说法中正确的是
x C(g) + 2D(g),容器里的压强逐渐降低,经5s后保持不变。在此5s内C的平均反应速率为0.1 mol·L-1·s-1。则下列的说法中正确的是