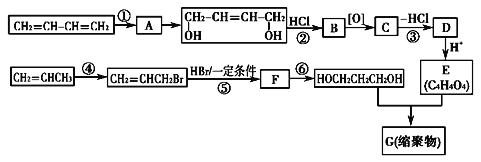
题目内容
【题目】2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
请回答下列问题:
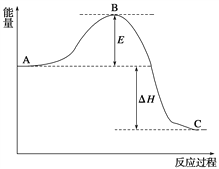
(1)图中A、C分别表示_______、_________,E的大小对该反应的反应热有无影响?________。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填升高或降低),理由是___________;
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=________mol/(L·min)、v(SO3)=________mol/(L·min);
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH_______________。
【答案】 反应物能量 生成物能量 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低 -198 0.025 0.05 -1 185 kJ/mol
【解析】试题分析:本题考查化学反应中能量变化的图像分析,催化剂对活化能的影响,化学反应速率的计算和盖斯定律。
(1)根据图示,图中A表示反应物能量,C表示生成物能量。E表示反应的活化能,反应热只与反应物能量和生成物能量的相对大小有关,与活化能无关,E的大小对反应热无影响。V2O5作催化剂,改变反应历程,降低反应的活化能E,从而使图中B点降低。
(2)1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol,则反应2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-198kJ/mol,图中ΔH=-198kJ/mol。
2SO3(g)ΔH=-198kJ/mol,图中ΔH=-198kJ/mol。
(3)根据同一反应中不同物质表示的化学反应速率之比等于化学计量数之比,υ(O2)=![]() υ(SO2)=0.025mol/(L·min),υ(SO3)=υ(SO2)=0.05mol/(L·min)。
υ(SO2)=0.025mol/(L·min),υ(SO3)=υ(SO2)=0.05mol/(L·min)。
(4)单质硫的燃烧热为296 kJ/mol,则S的燃烧热表示的热化学方程式为:S(s)+O2(g)=SO2(g)ΔH=-296kJ/mol(①式);2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-198kJ/mol(②式),应用盖斯定律,①式+②式
2SO3(g)ΔH=-198kJ/mol(②式),应用盖斯定律,①式+②式![]() 得,S(s)+
得,S(s)+![]() O2(g)=SO3(g)ΔH=(-296kJ/mol)+
O2(g)=SO3(g)ΔH=(-296kJ/mol)+![]() (-198kJ/mol)=-395kJ/mol;生成3molSO3(g)的ΔH=(-395kJ/mol)
(-198kJ/mol)=-395kJ/mol;生成3molSO3(g)的ΔH=(-395kJ/mol)![]() 3=-1185kJ/mol。
3=-1185kJ/mol。

 阅读快车系列答案
阅读快车系列答案【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
离子 | Na+ | Al3+ | Cl﹣ | X |
个数 | 2a | a | a | b |
A.NO3﹣、2a
B.SO42﹣、2a
C.OH﹣、2a
D.SO42﹣、4a
【题目】科学家利用石墨烯和具有粘弹性的聚硅树脂(俗称橡皮泥)制备出一种具有极高 灵敏度的电力学传感材料,能够检测轻微的变形和冲击,其灵敏程度甚至能探测到蜘蛛的运动。该材料可用于制作检测人体脉搏、血压的传感器等。实验室模拟工业合成方法,制备聚硅树脂的中间体氯甲基三乙氧基硅烷ClCH2Si(OEt)3 。量取20mL甲基三氯硅烷(CH3SiCl3)注入三口烧瓶中,开启电磁搅拌加热器升温至66℃,从a中加入浓盐酸,加热A一段时间,待温度升至110℃,停止加热,在三口烧瓶中加入30mL无水乙醇(EtOH),迅速反应生成氯甲基三乙氧基硅烷ClCH2Si(OEt)3,待温度降至室温后,将三口烧瓶中液体转移到蒸馏烧瓶中蒸馏,收集得到174.5℃馏分12mL。
物质 | C2H5OH | CH3SiCl3 | ClCH2SiCl3 | ClCH2Si(OEt)3 |
相对分子质量 | 46 | 149.5 | 184 | 212.5 |
熔点/℃ | -114.1 | -77.8 | — | — |
沸点/℃ | 78.3 | 66.4 | 116.5 | 174 |
密度/g·mL | 0.79 | 1.30 | 1.47 | 1.02 |
已知:甲基三氯硅烷为无色液体,具有刺鼻恶臭,易潮解;氯甲基三乙氧基硅烷易水解,能与碱金属氢氧化物生成碱金属硅醇盐。

(1)连接好装置后,检验装置气密性的操作是:_________________________________;
(2)A装置中发生反应的离子方程式是:_______________________________________;
装置C的作用是:_____________________ ;E中所装液体是:______________;
(3)装置D中发生反应的化学方程式为:① CH3SiCl3 + Cl2 → ClCH2SiCl3 + HCl
②__________________________________________________________________ ;
球形冷凝管的作用是:________________________;
(4)有同学发现该装置有一处不足可能会导致实验失败,应该__________________________________________________;
(5) 该方法制备氯甲基三乙氧基硅烷的产率是:_______________(保留两位有效数字)。