题目内容
【题目】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )
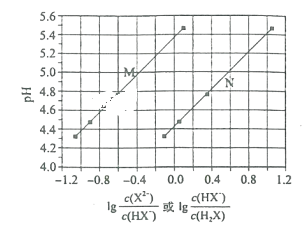
A.Ka1(H2X)的数量级为10-5
B.曲线N表示pH与lg![]() 的变化关系
的变化关系
C.NaHX溶液显碱性
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【答案】A
【解析】
H2X发生电离方程式为H2X![]() H++HX-,HX-
H++HX-,HX-![]() H++X2-,Ka1=
H++X2-,Ka1=![]() ,Ka2=
,Ka2=![]() 因为Ka1>Ka2,因此在相同pH时,
因为Ka1>Ka2,因此在相同pH时,![]() >
>![]() ,然后得出N点表示pH与lg
,然后得出N点表示pH与lg![]() 的变化关系,M点代表pH与lg
的变化关系,M点代表pH与lg![]() 的变化关系,据此分析。
的变化关系,据此分析。
H2X发生电离方程式为H2X![]() H++HX-,HX-
H++HX-,HX-![]() H++X2-,Ka1=
H++X2-,Ka1=![]() ,Ka2=
,Ka2=![]() 因为Ka1>Ka2,因此在相同pH时,
因为Ka1>Ka2,因此在相同pH时,![]() >
>![]() ,然后得出N点表示pH与lg
,然后得出N点表示pH与lg![]() 的变化关系,M点代表pH与lg
的变化关系,M点代表pH与lg![]() 的变化关系;
的变化关系;
A.取lg![]() =0,则
=0,则![]() =1,Ka1=
=1,Ka1=![]() =c(H+)≈10-4.4=10-5+0.6≈10-5,故A正确;
=c(H+)≈10-4.4=10-5+0.6≈10-5,故A正确;
B.根据上述分析,曲线N代表pH与lg![]() 的变化关系,故B错误;
的变化关系,故B错误;
C.NaHX中HX-的电离平衡常数Ka2=![]() ,取lg
,取lg![]() =0,则
=0,则![]() =1,此时对应的pH约为5.4,即Ka2的数量级约为10-6,HX-的水解平衡常数Kh=
=1,此时对应的pH约为5.4,即Ka2的数量级约为10-6,HX-的水解平衡常数Kh=![]() =10-9<10-6,说明HX-的电离大于其水解,溶液显酸性,故C错误;
=10-9<10-6,说明HX-的电离大于其水解,溶液显酸性,故C错误;
D.混合溶液呈中性,c(H+)=c(OH-),混合溶液中的溶质为Na2X和NaHX,X2-的水解平衡常数Kh=![]() =10-8<Ka2=10-6,说明c(Na2X)>c(NaHX),从而得出离子浓度大小顺序是c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-),故D错误;
=10-8<Ka2=10-6,说明c(Na2X)>c(NaHX),从而得出离子浓度大小顺序是c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-),故D错误;
答案:A。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目