题目内容
【题目】如图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1,B为常见液体。
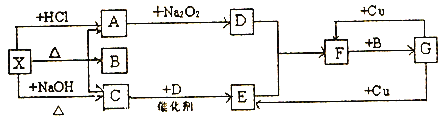
试回答下列问题:
(1)X是_____;F是____。(写化学式)
(2)写出C→E反应的化学方程式并用双线桥标出电子转移的方向和数目__________。
(3)G与Cu的反应中,G表现_______性质。
(4)写出X→A的离子方程式:__________。
(5)以C、B、D为原料可生产G,若使amolC的中心原子完全转化到G中,理论上至少需要D___mol。
【答案】NH4HCO3 NO2  酸性和氧化性 H++HCO3﹣==H2O+CO2↑ 2a
酸性和氧化性 H++HCO3﹣==H2O+CO2↑ 2a
【解析】
X能与盐酸、氢氧化钠反应都生成气体,X应为弱酸的铵盐,与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C为NH3,A与C物质的量之比为1:1,且B为常见液体,可以推知X为NH4HCO3、B为H2O,C(氨气)与D(氧气)反应生成E为NO,E与氧气反应生成F为NO2,F与水反应得到G,G能与Cu反应生成NO、NO2,则G为HNO3。
(1).由上述分析可知,X是NH4HCO3;F是NO2,故答案为:NH4HCO3;NO2;
(2).氨气与氧气反应生成NO和水,在该反应中,氮元素的化合价从-3价升高到+2价,氧元素的化合价从0价降低到-2价,根据得失电子守恒和原子守恒,用双线桥法表示该反应的式子为: ,故答案为:
,故答案为: ;
;
(3). Cu与硝酸反应生成硝酸铜、氮的氧化物和水,反应中N元素的化合价部分未发生变化,部分降低,则硝酸表现酸性、氧化性,故答案为:酸性和氧化性;
(4). NH4HCO3与盐酸反应生成氯化铵、二氧化碳和水,该反应的离子方程式为:H++HCO3-==H2O+CO2↑,故答案为:H++HCO3-==H2O+CO2↑;
(5)以NH3、H2O、O2为原料可生产HNO3,使amolNH3完全转化为HNO3,根据得失电子守恒,理论上至少需要氧气的物质的量=![]() =2amol,故答案为:2a。
=2amol,故答案为:2a。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案