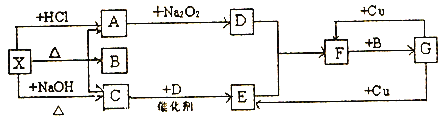
题目内容
【题目】用18.4mol/L的浓H2SO4配制100mL浓度为1.0mol/L的稀H2SO4,其操作可分为以下各步:
(1)A.用量简量取_____浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒搅拌;
B.用约30mL蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注人容量瓶中;
C.将稀释后的H2SO4小心转移到100mL容量瓶里;
D.检查100mL容量瓶口部是否会发生滴漏;
E.加蒸馏水至容量瓶中液面接近刻度2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平。
(2)上述操作正确的顺序为(用字母填写)__________。
(3)进行A步操作时,应选择下列量器_______(填序号)。
a.10mL量筒 b.50mL量筒 c.100mL量筒
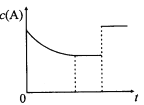
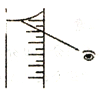
(4)如果对装有浓H2SO4的量筒读数如右图所示,配制的稀H2SO4的浓度将_______(偏高、偏低、无影响)。
(5)进入A步操作后,必须________后才能进行C操作。
【答案】5.4mL DACBEGF a 偏高 冷却至室温
【解析】
(1).设需要量取xmL的浓硫酸,根据稀释定律,x×10-3L×18.4mol/L=0.1L×1.0mol/L,解得x=5.4mL,故答案为:5.4mL;
(2).用浓溶液配制一定物质的量浓度的稀溶液,一般操作步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的顺序为:DACBEGF,故答案为:DACBEGF;
(3).依据量筒选择原则可知量取5.4mL溶液,应选择10mL量筒,故答案为:a;
(4).仰视量筒读数,会导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,配制的溶液浓度偏高,故答案为:偏高;
(5).容量瓶为精密仪器,不能用来配制过热或过冷的液体,所以移液前应冷却至室温,故答案为:冷却至室温。

 华东师大版一课一练系列答案
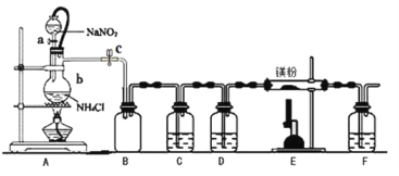
华东师大版一课一练系列答案【题目】氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备 Mg3N2 并进行有关实验。实验装置如下所示: (部分加热装置已略去)
已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器 b 的名称是__________,写出装置 A 中发生反应的化学方程式___________。
(2)某同学检验装置 A 部分的气密性,关闭止水夹 c 后,开启活塞 a,水不断往下滴,直至全部流入烧瓶。试判断:
A 部分装置是否漏气? ________ (填“漏气”、“不漏气”或“无法确定”),判断理由是____________。
(3)装置 C 中为饱和硫酸亚铁溶液, 其作用是___________,装置 F 的作用是________。
(4)加热至反应开始发生,需移走 A 处酒精灯,原因是__________________。
(5)定性分析产物
操作步骤 | 实验现象 | 解释原因 |
取少量产品于试管中, 加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | 反应的化学方程式为 __________________________________ |
弃去上层淸液, 加入足量稀盐酸 | 观察到固体全部溶解, 且有气泡冒出 | 气泡冒出的原因为___________________________________________________ |