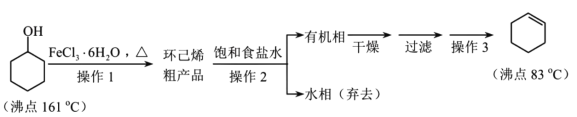
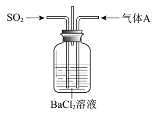
题目内容
【题目】室温下,将一元酸 HA 的溶液和 KOH 溶液等体积混合(忽略体积变化),实验数据如下表:

下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=KW/1×10-9mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
【答案】B
【解析】
室温下,将等体积等浓度的HA和KOH混合(忽略体积变化),溶液呈碱性,说明该酸是弱酸。
A.溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),该盐是强碱弱酸盐,其溶液呈碱性,c(OH-)>c(H+),水的电离较微弱,所以c(A-)>c(OH-),故A正确;
B.溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),c(OH-)-c(H+)=c(K+)-c(A-)=![]() mol/L-10-9mol/L,故B错误;
mol/L-10-9mol/L,故B错误;
C.当等物质的量的酸和碱恰好反应时,溶液呈碱性,要使等体积的酸和碱混合后溶液呈中性,则酸的浓度应大于碱,根据物料守恒得c(A-)+c(HA)>0.1 mol/L,故C正确;
D.溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),溶液呈中性,即c(OH-)=c(H+),则c(K+)=c(A-),中性溶液中水的电离较微弱,所以c(A-)>c(OH-),故D正确;
故选B。
【点晴】
本题考查离子浓度大小的比较,根据电荷守恒和微粒守恒来分析解答即可,易错选项是C.在探究离子浓度问题,要充分认识电解质在溶液中的表现,全面考虑溶液中各种离子的存在情况及相互关系,比如:在Na2CO3溶液中存在Na2CO3的电离,CO32-的水解、二级水解以及H2O的电离等多个反应,故溶液中微粒有H2O、Na+、CO32-、HCO3-、H2CO3、H+、OH-,忽视任何一个很微弱的反应、很微少的粒子都是不正确的等方面的因素。

 阅读快车系列答案
阅读快车系列答案