题目内容
16.下列实施中,能说明HNO2是弱电解质的是( )| A. | 用HNO2溶液做导电性试验,灯光较暗 | |
| B. | HNO2是共价化合物 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 常温下,0.1mol.L-1HNO2溶液的pH为2.15 |
分析 强弱电解质的本质区别是电解质电离程度,部分电离的电解质是弱电解质,要证明亚硝酸是弱电解质,只要证明亚硝酸在水溶液中部分电离即可,据此分析解答.
解答 解:A.用HNO2溶液做导电性试验,灯光较暗,溶液导电能力与离子浓度有关,与电解质强弱无关,不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱电解质,故A错误;
B.电解质强弱与电离程度有关,与共价化合物、离子化合物无关,如:硫酸、硝酸都是共价化合物,但二者都是强电解质,故B错误;
C.亚硝酸与氯化钠不反应,说明不符合复分解反应条件,但不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱电解质,故C错误;
D.常温下,0.1mol.L-1HNO2溶液的PH为2.15,氢离子浓度小于亚硝酸浓度,则亚硝酸部分电离,为弱电解质,故D正确;
故选D.
点评 本题考查弱电解质判断,为高频考点,电解质强弱是根据其电离程度划分的,与电解质溶液导电性无关,易错选项是AC.

练习册系列答案
相关题目
7.能与NaOH溶液反应放出气体,向反应后的溶液里通入足量CO2时能得到沉淀的是( )
| A. | Mg | B. | Al | C. | Si | D. | Cl2 |
4.根据你的实验观察和记录,下面关于Na2CO3和NaHCO3性质的叙述,正确的是( )
| A. | 受热时Na2CO3比NaHCO3稳定 | |
| B. | 同温同压下,在水中Na2CO3比NaHCO3溶解性小 | |
| C. | 物质的量相等的Na2CO3和NaHCO3分别溶于等体积的水后,Na2CO3水溶液的碱性较弱 | |
| D. | 质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出的CO2少 |
11.下列关于元素周期表的说法不正确的是( )
| A. | 元素周期表中一共有16个纵行 | |
| B. | 除零族元素外,非金属元素全都是主族元素 | |
| C. | 同周期ⅡA族与ⅢA族元素的原子序数之差可能为25 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
1.下列反应中,硫酸不作氧化剂的是( )
| A. | 2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2+SO2↑+2H2O | |
| B. | Ca3(PO4)2+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+Ca(H2PO4)2 | |
| C. | 2Al+3H2SO4═Al2(SO4)3+3H2↑ | |
| D. | 2KMnO4+5H2S+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
8.某有机物的结构简式如图,下列关于该有机物的叙述不正确的是( )
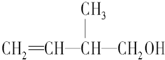

| A. | 能与金属钠反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 能发生银镜反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
5.下列关于物质性质变化的比较,不正确的是( )
| A. | 非金属性:P<S<O<F | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |

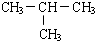 ,它的一氯取代产物有2种.
,它的一氯取代产物有2种.