题目内容
1.现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请回答问题:(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”).
(2)取10mL的甲溶液,加入少量无水醋酸钠固体,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)小于pH(乙)(填“大于”、“小于”或“等于”).
(4)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)大于V(乙) (填“大于”、“小于”或“等于”).
(5)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)小于c(CH3COO-) (填“大于”、“小于”或“等于”).
分析 (1)醋酸是弱电解质,加水稀释促进醋酸电离;
(2)向醋酸中加入醋酸钠固体,溶液中醋酸根离子浓度增大,抑制醋酸电离;
(3)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离;
(4)pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大;
(5)pH=12的NaOH溶液中c(NaOH)=0.01mol/L,pH=2的醋酸中c(CH3COOH)>0.01mol/L,二者等体积混合,醋酸过量,溶液呈酸性,根据电荷守恒分析.
解答 解:(1)醋酸是弱电解质,加水稀释促进醋酸电离,所以醋酸电离平衡向正反应方向移动;故答案为:向正反应方向;
(2)向醋酸中加入醋酸钠固体,溶液中醋酸根离子浓度增大,抑制醋酸电离,则氢离子浓度减小,醋酸分子浓度增大,所以溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小,
故答案为:减小;
(3)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,所以醋酸溶液中氢离子浓度减小程度大于盐酸溶液中氢离子浓度减小程度,所以醋酸的pH小于盐酸,
故答案为:小于;
(4)pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大,所以V(甲)大于V(乙),故答案为:大于;
(5)pH=12的NaOH溶液中c(NaOH)=0.01mol/L,pH=2的醋酸中c(CH3COOH)>0.01mol/L,二者等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)<c(CH3COO-),
故答案为:小于.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意相同浓度的不同酸稀释时其pH变化大小,结合电荷守恒分析解答,难度中等.

| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 熔点:对二甲苯>邻二甲苯>间二甲苯 | |
| D. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |
| A. | 将某种稀酸溶液,用蒸馏水稀释10倍,其pH一定增大一个单位 | |
| B. | 100℃时的NaCl溶液,PH约为6时呈中性. | |
| C. | pH相同的醋酸和H2SO4分别能恰好中和等物质的量的NaOH | |
| D. | 将0.1mol/L CH3COOH溶液加水稀释10倍,溶液中所有离子的浓度均减小 |
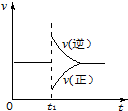 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )| A. | t1时改变某一条件,平衡将向逆反应方向移动 | |
| B. | 维持压强不变,t1时升高反应体系温度 | |
| C. | 维持温度不变,t1时扩大反应体系体积 | |
| D. | 维持温度、压强不变,t1时充入SO2(g) |
| A. | 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3 | |
| B. | 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O | |
| C. | 制硫酸铜:Cu+2H2SO4=CuSO4+SO2↑+2H2O | |
| D. | 制硫酸铜:2Cu+O2=2CuO CuO+H2SO4(稀)=CuSO4+H2O |
| A. | 铜、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 | |
| C. | 将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L | |
| D. | 实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g |
| A. | 熔融状态下能导电的物质是电解质 | |
| B. | BaSO4虽然难溶,但是强电解质 | |
| C. | NH3的水溶液能导电,所以NH3是电解质 | |
| D. | 弱电解质溶液的导电性比强电解质溶液弱 |
| A. | 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在 | |
| B. | 用酸性KMnO4溶液检验溴乙烷与NaOH醇溶液共热后的产物是否是乙稀 | |
| C. | 用溴水鉴别乙烯与乙炔 | |
| D. | CH4和Cl2在光照条件下反应的产物最多可能有四种 |