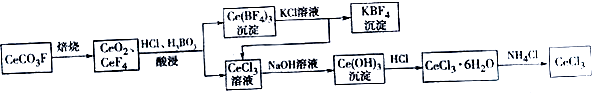
题目内容
【题目】常温下,向20.00mL 0.1000molL﹣1 (NH4)2SO4溶液中逐滴加入0.2000molL﹣1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( ) 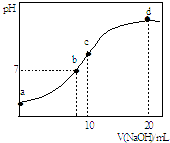
A.点a所示溶液中:c(SO42﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH﹣)
C.点d所示溶液中:c(SO42﹣)>c(NH3H2O )>c(OH﹣)>c(NH4+)
D.点c所示溶液中:c(SO42﹣)+c(H+)=c(NH3H2O )+c(OH﹣)
【答案】D
【解析】解:A.a点溶液中,铵根离子水解导致溶液呈酸性,即c(H+)>c(OH﹣),铵根离子水解程度较小,结合物料守恒知c(NH4+)>c(SO42﹣),所以溶液中离子浓度大小顺序是c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣),故A错误;
B.b点溶液中,溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42﹣)+c(OH﹣),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH4+)>c(Na+),故B错误;
C.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3H2O )>c(SO42﹣),故C错误;
D.c点溶液中,溶液呈碱性,所以c(H+)<c(OH﹣),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42﹣)+c(OH﹣),根据物料守恒得,根据物料守恒得c(NH4+)+c(NH3H2O)=2c(SO42﹣)=2c(Na+),所以得c(SO42﹣)+c(H+)=c(NH3H2O )+c(OH﹣),故D正确;
故选D.
A.a点溶液中,铵根离子水解导致溶液呈酸性,但铵根离子水解较微弱;
B.b点溶液中,溶液呈中性,则c(H+)=c(OH﹣),根据溶质的性质判断;
C.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半;
D.c点溶液中存在电荷守恒和物料守恒,根据电荷守恒、物料守恒判断.