题目内容
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下: 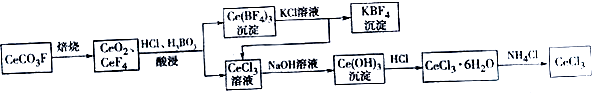
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为 .
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染.写出稀硫酸、H2O2与CeO2反应的离子方程式: .
(3)向Ce(BF4)3中加入KCl溶液的目的是 .
(4)溶液中的C(Ce3+)等于1×10﹣5molL﹣1 , 可认为Ce3+沉淀完全,此时溶液的PH为 . (已知KSP[Ce(OH)3]=1×10﹣20)
(5)加热CeCl36H2O和NH4Cl的固体混合物可得到无水CeCl3 , 其中NH4Cl的作用是 .
(6)准确称取0.7500gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+ , 然后用0.1000moll﹣1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00mL标准溶液.(已知:Fe2+Ce4+═Ce3++Fe3+) ①该样品中CeCl3的质量分数为 .
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数(填“偏大”、“偏小”或“无影响”)
【答案】
(1)+3
(2)H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑
(3)避免三价铈以Ce(BF4)3沉淀的形式损失或除去BF4﹣或提高CeCl3的产率
(4)9
(5)NH4Cl固体受热分解产生HCl,抑制CeCl3水解
(6)82.2%;偏大
【解析】解:利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程为,CeCO3F焙烧得CeO2、CeF4 , 用盐酸和硼酸酸浸,过滤得沉淀Ce(BF)4和CeCl3滤液,Ce(BF)4与氯化钾溶液反应得到CeCl3和KBF,CeCl3与前面滤液中CeCl3的合并再加氢氧化钠,得Ce(OH)3沉淀,Ce(OH)3沉淀与盐酸反应可得CeCl36H2O,加热CeCl36H2O和NH4Cl的固体混合物可得到无水CeCl3 , (1)根据化合价代数和为0可知,CeCO3F中,Ce元素的化合价为+3价, 所以答案是:+3; (2)稀硫酸、H2O2与CeO2反应的离子方程式为:H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑,
所以答案是:H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑; (3)向Ce(BF4)3中加入KCl溶液生成CeCl3和KBF,这样做的目的是避免三价铈以Ce(BF4)3沉淀的形式损失或除去BF4﹣或提高CeCl3的产率,
所以答案是:避免三价铈以Ce(BF4)3沉淀的形式损失或除去BF4﹣或提高CeCl3的产率; (4)溶液中的C(Ce3+)等于1×10﹣5molL﹣1 , 可认为Ce3+沉淀完全,根据KSP[Ce(OH)3]=C(Ce3+)C3(OH﹣)=1×10﹣20可知,C(OH﹣)= ![]() molL﹣1=1×10﹣5molL﹣1 , 此时溶液的PH为9,
molL﹣1=1×10﹣5molL﹣1 , 此时溶液的PH为9,
所以答案是:9; (5)由于NH4Cl固体受热分解产生HCl,抑制CeCl3水解,所以加热CeCl36H2O和NH4Cl的固体混合物可得到无水CeCl3 ,
所以答案是:NH4Cl固体受热分解产生HCl,抑制CeCl3水解; (6)①0.1000moll﹣1(NH4)2Fe(SO4)2标准溶液体积25.00mL,含有亚铁离子的物质的量为2.5×10﹣3mol,根据反应Fe2++Ce4+═Ce3++Fe3+ , 利用Ce元素守恒可知,CeCl3的质量为2.5×10﹣3mol×246.5g/mol=0.6163g,所以样品中CeCl3的质量分数为 ![]() ×100%=82.2%,
×100%=82.2%,
所以答案是:82.2%;
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,由于亚铁离子被空气中氧气氧化,所以会消耗标准液的体积为偏大,则测得该CeCl3样品的质量分数偏大,
所以答案是:偏大.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】已知:O2(g)+2H2(g)=2H2O(g)△H=﹣483.6kJmol﹣1
C(s,石墨)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJmol﹣1
(1)请写出CO与水蒸汽反应的热化学方程式
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)= , 请计算此时的平衡常数K= . 
时间/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min~4min之间反应处于状态;c1数值0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因(填字母),表中5min~6min之间数值发生变化,可能的原因是 . (填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.